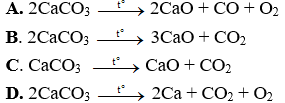Đề thi Học kì 1 Hóa học lớp 9 năm 2023 có ma trận (8 đề)
Đề thi Học kì 1 Hóa học lớp 9 năm 2023 có ma trận (8 đề)
Haylamdo biên soạn và sưu tầm Đề thi Học kì 1 Hóa học lớp 9 năm 2023 có ma trận (8 đề) được tổng hợp chọn lọc từ đề thi môn Hóa học 9 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hóa lớp 9.

MA TRẬN ĐỀ THI HỌC KÌ 1.
MÔN HÓA HỌC 9
NĂM HỌC 2023
|
Tên Chủ đề (nội dung, chương…) |
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
Cộng |
||||||||
|
TNKQ |
TL |
TNKQ |
TL |
TNKQ |
TL |
TNKQ |
TL |
|
|||||
|
Chủ đề 2: Axit |
- Tính chất hóa học của axit. |
|
- Tính khối lượng dung dịch sau phản ứng của kim loại và axit. |
|
|
||||||||
|
Số câu Số điểm Tỉ lệ % |
2 2/3đ 6,67% |
|
|
|
1 1/3đ 3,33% |
|
|
|
3 1đ 10% |
||||
|
Chủ đề 3: Bazơ |
- Tính chất hóa học của bazơ - Thang pH |
|
Tính nồng độ mol của dung dịch bazơ |
|
|
||||||||
|
Số câu Số điểm Tỉ lệ % |
2 2/3đ 6,67% |
|
|
|
1 1/3đ 3,33% |
|
|
|
3 1đ 10% |
||||
|
Chủ đề 4: Muối |
- Tính chất vật lí, tính chất hóa học của muối, |
- Xác định loại phản ứng |
- Xác định cặp chất không thể tồn tại trong 1 dung dịch - Tính khối lượng muối trong dung dịch - Tính nồng độ mol của dung dịch muối |
|
|
||||||||
|
Số câu Số điểm Tỉ lệ % |
3 1đ 10% |
|
1 1/3đ 3,33% |
|
3 1đ 10% |
|
|
|
7 7/3đ 23,3% |
||||
|
Chủ đề 5: Phân bón hóa học |
|
|
Xác định loại phân bón hóa học |
|
Tính % hàm lượng dinh dưỡng trong phân |
|
|
|
|
||||
|
Số câu Số điểm Tỉ lệ % |
|
|
1 1/3đ 3,33% |
|
1 1/3đ 3,33% |
|
|
|
2 2/3đ 6,67% |
||||
|
Chủ đề 6: Mối quan hệ giữa các loại hợp chất vô cơ |
|
- Xác định sản phẩm tạo thành sau phản ứng giữa axit và muối.
|
- Nhận biết các dung dịch
|
|
|
||||||||
|
Số câu Số điểm Tỉ lệ % |
|
|
1 1/3đ 3,33% |
|
1 1/3đ 3,33% |
|
|
|
2 2/3đ 6,67% |
||||
|
Chủ đề 7: Tính chất chung của kim loại, dãy hoạt động hóa học của kim loại |
- Nêu được tính chất vật lí, hóa học của kim loại |
|
- Sắp xếp các kim loại theo mức độ hoạt động hóa học - Ứng dụng tính chất vật lí của kim loại vào thực tế |
|
|
|
- Tính khối lượng muối thu được. - Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp |
|
|
||||
|
Số câu Số điểm Tỉ lệ % |
3 1đ 10% |
|
3 1đ 10% |
|
|
|
2 2/3đ 6,67% |
|
8 8/3đ 26,67% |
||||
|
Chủ đề 8: Sắt, nhôm và hợp chất |
Tính chất vật lí của sắt, nêu được công thức hóa học của quặng sắt |
|
So sánh tính chất hóa học của nhôm và sắt - Ứng dụng các biện pháp bảo vệ kim loại chống ăn mòn |
|
Phân biệt hỗn hợp kim loại |
|
|
|
|
||||
|
Số câu Số điểm Tỉ lệ % |
2 2/3đ 6,67% |
|
2 2/3đ 6,67% |
|
1 1/3đ 3,33% |
|
|
|
5 câu |
||||
|
Tổng số câu Tổng số điểm Tỉ lệ % |
12 4đ 42% |
|
8 8/3đ 26,67% |
|
8 8/3đ 26,67% |
|
2 2/3đ 6,67% |
|
30 10 đ 100% |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit là:
A. CaCO3 và HCl B. Na2SO3 và H2SO4
C. CuCl2 và KOH D. K2CO3 và HNO3
Câu 2: Chất có thể tác dụng với nước cho 1 dung dịch làm quỳ tím chuyển màu thành đỏ
A. MgO B. CO C. CaO D. SO3
Câu 3: Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn tác dụng hoàn toàn với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam B. 11,5 gam
C. 15,71 gam D. 17,19 gam
Câu 4: Nhỏ vài giọt dung dịch FeCl3 vào ống nghiệm đựng 1ml dung dịch NaOH, thấy xuất hiện
A. chất không tan màu nâu đỏ
B. chất không tan màu trắng
C. chất tan không màu
D. chất không tan màu xanh lơ
Câu 5: Dung dịch của chất X có pH > 7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
A. BaCl2 B. NaOH C. Ba(OH)2 D. H2SO4.
Câu 6: Hoà tan 23,5 g kali oxit vào nước được 0,5 lít dung dịch A. Nồng độ mol của dung dịch A là:
A. 0,25M. B. 0,5M C. 1M. D. 2M.
Câu 7: Nung muối canxi cacbonat ở nhiệt độ trên 900oC thu được khí gì?
A. SO2 B. CO2 C. O2 D. SO3
Câu 8: Muối nào sau đây không tan.
A. K2SO3 B. Na2SO3 C. CuCl2 D. BaSO4
Câu 9: Chất tác dụng với dung dịch muối Al2(SO4)3 ở nhiệt độ thường là
A. H2O B. CaCl2 C. Fe(OH)2 D. Mg
Câu 10: Phản ứng nào dưới đây là phản ứng trao đổi?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 + H2
D. BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 11: Cặp chất nào sau đây không thể tồn tại trong 1 dung dịch (phản ứng với nhau)?
A. NaOH, MgSO4 B. KCl, Na2SO4
C. CaCl2, NaNO3 D. ZnSO4, H2SO4
Câu 12: Cho 1,84 hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít CO2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là:
A. 1,17g B. 3,17g C. 2,17g D. 4,17g
Câu 13: Hòa tan 0,25 mol NaCl vào nước, thu được 2 lit dung dịch NaCl. Vậy nồng độ mol của dung dịch trên là
A. 0,125M B. 0,25M C. 1,25M D. 0,5M
Câu 14: Cho các phát biểu sau:
(1) Phân amoni nitrat NH4NO3 chứa 21% nitơ
(2) Phân photphat tự nhiên có thành phần chính là Ca3(PO4)2, tan chậm trong đất chua
(3) Các phân bón KCl, K2SO4, Ca(H2PO4)2 và (NH2)2CO đều là phân bón đơn
(4) Cu(OH)2, Fe(OH)3, Al(OH)3, Ba(OH)2 đều bị nhiệt phân hủy cho oxit và nước
(5) SO2, SO3, N2O5, P2O5, CO, CO2 là những oxit axit
(6) Các bazơ Mg(OH)2, Fe(OH)2, Ca(OH)2 đều có thể làm quỳ tím hóa xanh
Số phát biểu sai là:
A. 2 B. 3 C. 4 D. 5
Câu 15: Trong các loại phân bón hóa học sau, loại nào là phân đạm?
A. KCl B. Ca3(PO4)2
C. K2SO4 D. (NH2)2CO
Câu 16: Cho AgNO3 tác dụng với HCl sản phẩm của phản ứng có
A. H2O B. AgCl C. NaOH D. H2.
Câu 17: Một trong những thuốc thử nào sau đây có thể dùng để phân biệt dung dịch muối Na2CO3 và Na2SO4?
A. MgCl2 B. Pb(NO3)2 C. AgNO3 D. HCl
Câu 18: Những tính chất vật lí chung của kim loại là:
A. Tính dẻo, có ánh kim và rất cứng.
B. Tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao.
C. Tính dẫn điện, dẫn nhiệt, có ánh kim, có khối lượng riêng lớn.
D. Tính dẻo, tính dẫn điện, dẫn nhiệt, và có ánh kim.
Câu 19: Trong các kim loại sau đây, kim loại dẫn điện tốt nhất là:
A. Nhôm (Al) B. Bạc (Ag) C. Đồng (Cu) D. Sắt (Fe)
Câu 20: Axit nào tác dụng được với Mg tạo ra khí H2:
A. H2SO4 đặc, HCl B. HCl, H2SO4 loãng
C. HNO3loãng, H2SO4 loãng D. HNO3 đặc, H2SO4đặc
Câu 21: Không sử dụng dây điện trần trong sinh hoạt vì
A. dễ nóng chảy. B. dễ bị điện giật.
C. mất thẩm mỹ. D. dẩn điện không tốt.
Câu 22: Dãy các kim loại nào sau đây được sắp xếp theo chiều hoạt động hóa học giảm dần?
A. Cu, Ag, Fe, Al, Mg, K B. K, Mg, Al, Fe, Cu, Ag.
C. Ag, Cu, Fe, Al, Mg, K. D. K, Mg, Al, Cu, Ag, Fe.
Câu 23: Để bảo quản kim loại Na trong phòng thí nghiệm, người ra thường ngâm Na trong chất nào dưới đây?
A. H2O. B. Dung dịch H2SO4 đặc.
C. Dung dịch HCl. D. Dầu hỏa.
Câu 24: Đun nóng 6,4 g lưu huỳnh và 1,3 g kẽm. Sau phản ứng thu được các chất với khối lượng là:
A. 2,17g Zn và 0,89g S B. 5,76 g S và 1,94 g ZnS
C. 2,12 g ZnS D. 7,7 g ZnS
Câu 25: Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần % theo khối lượng của Cu và Zn lần lượt là:
A. 61,9% và 38,1% B. 38,1% và 61,9%
C. 65% và 35% D. 35% và 65%
Câu 26: Thành phần chính của quặng pirit là
A. Fe2O3 B. FeS2 C. Fe3O4 D. Al2O3
Câu 27: Sắt bị nam châm hút là do
A. Sắt là kim loại nặng. B. Sắt có từ tính.
C. Sắt có màu trắng. D. Sắt có tính dẫn điện
Câu 28: Nhôm hoạt động hoá học mạnh hơn sắt, vì:
A. Al, Fe đều không phản ứng với HNO3 đặc nguội.
B. Al có phản ứng với dung dịch kiềm.
C. Nhôm đẩy được sắt ra khỏi dung dịch muối sắt.
D. Chỉ có sắt bị nam châm hút.
Câu 29: Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. NaOH và FeCl2 B. HCl và CuCl2
C. Ca(OH)2 và NaCl D. HCl và NaOH
Câu 30: Sau một ngày lao động người ta phải làm vệ sinh các thiết bị, máy móc, dụng cụ lao động bằng kim loại. Việc làm này có mục đích chính là gì?
A. Để kim loại sáng bóng đẹp mắt.
B. Để không gây ô nhiễm môi trường
C. Để không làm bẩn quần áo khi lao động
D. Để kim loại đỡ ăn mòn
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I - TRẮC NGHIỆM (7 Điểm)
Câu 1: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg. B. Zn, Fe, Cu.
C. Zn, Fe, Al. D. Fe, Zn, Ag
Câu 2: MgCO3 tác dụng với dung dịch HCl sinh ra:
A. Chất khí cháy được trong không khí
B. Chất khí làm vẫn đục nước vôi trong.
C. Chất khí duy trì sự cháy và sự sống.
D. Chất khí không tan trong nước.
Câu 3: Cho 0,2 mol canxi oxit tác dụng với 500 ml dung dịch HCl 1M. Khối lượng muối thu được là:
A. 2,22 g B. 22,2 g C. 23,2 g D. 22,3 g
Câu 4: Có những bazơ Ba(OH)2, Mg(OH)2, Cu(OH)2, Ca(OH)2. Nhóm các bazơ làm quỳ tím hoá xanh là:
A. Ba(OH)2, Cu(OH)2 B. Ba(OH)2, Ca(OH)2
C. Mg(OH)2, Ca(OH)2 D. Mg(OH)2, Ba(OH)2
Câu 5: Nhóm các dung dịch có pH > 7 là:
A. HCl, HNO3 B. NaCl, KNO3
C. NaOH, Ba(OH)2 D. Nước cất, nước muối
Câu 6: NaOH có tính chất vật lý nào sau đây?
A. Natri hiđroxit là chất rắn không màu, ít tan trong nước
B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt
C. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt
D. Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Câu 7: Cho dung dịch axit sunfuric loãng tác dụng với muối natrisunfit (Na2SO3). Chất khí nào sinh ra?
A. Khí hiđro B. Khí oxi
C. Khí lưu huỳnh đioxit D. Khí hiđro sunfua
Câu 8: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh. B. Có khí thoát ra.
C. Có kết tủa đỏ nâu. D. Kết tủa màu trắng.
Câu 9: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh. B. Có khí thoát ra.
C. Có kết tủa đỏ nâu. D. Kết tủa màu trắng.
Câu 10: Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
A. Quỳ tím và dung dịch HCl
B. Phenolphtalein và dung dịch BaCl2
C. Quỳ tím và dung dịch K2CO3
D. Quỳ tím và dung dịch NaCl
Câu 11: Để nhận biết dung dịch NH4NO3, Ca3 (PO4)2, KCl người ta dùng dung dịch:
A. NaOH B. Ba(OH)2 C. KOH D. Na2CO3
Câu 12: Trong các kim loại sau đây, kim loại dẻo nhất là:
A. Đồng (Cu) B. Nhôm (Al) C. Bạc (Ag) D. Vàng (Au )
Câu 13: Lấy một ít bột Fe cho vào dung dịch HCl vừa đủ rồi nhỏ từ từ dung dịch NaOH đến dư vào dung dịch. Hiện tượng xảy ra là:
A. Có khí bay ra và dung dịch có màu xanh lam.
B. Không thấy hiện tượng gì.
C. Ban đầu có khí thoát ra và dd có kết tủa trắng xanh rồi chuyển dần thành màu nâu đỏ.
D. Có khí thoát ra và tạo kết tủa màu xanh đến khi kết thúc.
Câu 14: Khi phân tích định lượng ta thấy trong muối sunfat của kim loại M có hoá trị II hàm lượng M là 29,41% về khối lượng. Vậy M là:
A. Cu B. Fe C. Ca D. Mg
Câu 15: Hoà tan 9 g hợp kim nhôm – magie vào dung dịch H2SO4 dư thu được 10,08 lít khí H2 (đktc). Thành phần % khối lượng của Al và Mg trong hợp kim lần lượt là:
A. 50% và 50% B. 40% và 60%
C. 60% và 40% D. 39% và 61%
Câu 16: Để làm sạch một mẫu đồng kim loại có lẫn sắt kim loại và kẽm kim loại có thể ngâm mẫu đồng vào dung dịch
A. FeCl2 dư B. ZnCl2 dư C. CuCl2 dư D. AlCl3 dư
Câu 17: Có 4 kim loại X, Y, Z, T đứng sau Mg trong dãy hoạt động hóa học. Biết Z và T tan trong dung dịch HCl, X và Y không tan trong dung dịch HCl , Z đẩy được T trong dung dịch muối T, X đẩy được Y trong dung dịch muối Y. Thứ tự hoạt động hóa học của kim loại tăng dần như sau:
A. T, Z, X, Y B. Z, T, X, Y
C. Y, X, T, Z D. Z, T, Y, X
Câu 18: Nhôm bền trong không khí là do
A. Nhôm nhẹ, có nhiệt độ nóng chảy cao
B. Nhôm không tác dụng với nước.
C. Nhôm không tác dụng với oxi.
D. Có lớp nhôm oxit mỏng bảo vệ.
Câu 19: Thành phần chính của đất sét là Al2O3.2SiO2.2H2O. Phần trăm khối lượng của nhôm trong hợp chất trên là:
A. 20,93 % B. 10,46 % C. 24,32 % D. 39,53 %.
Câu 20: Hoà tan hỗn hợp gồm Fe và Cu vào dung dịch HCl (vừa đủ). Các sản phẩm thu được sau phản ứng là:
A. FeCl2 và khí H2 B. FeCl2, Cu và khí H2
C. Cu và khí H2 D. FeCl2 và Cu
II – TỰ LUẬN (3 điểm)
Câu 1: (1,5 điểm) Có 4 dung dịch đựng trong 4 ống nghiệm riêng biệt không dán nhãn là NaOH, HCl, NaNO3, NaCl. Hãy nêu các phương pháp hóa học để phân biệt 4 dung dịch này. Viết các phương trình hóa học (nếu có) để minh họa.
Câu 2: (1,5 điểm) Lấy 5 gam hỗn hợp hai muối là CaCO3 và CaSO4 cho tác dụng vừa đủ với dung dịch HCl tạo thành 448 ml khí (đktc). Tính thành phần % theo khối lượng của mỗi muối trong hỗn hợp ban đầu.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Dãy gồm các chất đều là bazơ tan là:
A. NaOH, KOH, Ba(OH)2 B. Ca(OH)2, Mg(OH)2, Cu(OH)2
C. NaOH, KOH, Al(OH)3 D. Ba(OH)2, Fe(OH)3, NaOH
Câu 2: Chất nào sau đây tác dụng được với dung dịch axit H2SO4 loãng
A. Cu B. HCl C. CO2 D. Zn
Câu 3: Chất có thể tác dụng với nước cho 1 dung dịch làm quỳ tím chuyển màu thành đỏ
A. MgO B. SO3 C. CaO D. CO
Câu 4: Hãy chọn cách sắp xếp theo tính hoạt động hóa học tăng dần (từ trái sang phải) của các nhóm kim loại sau:
A. Al, Zn, Fe, Na, Cu, Ag, Pb
B. Ag, Cu, Pb, Fe, Zn, Al, Na
C. Ag, Cu, Pb, Zn, Fe, Al, Na
D. Ag, Pb, Cu, Fe, Zn, Al, Na
Câu 5: Có 3 lọ mất nhãn đựng các hóa chất sau: HCl, H2SO4, NaOH. Hãy chọn thuốc thử nào sau đây để nhận biết dung dịch trong mỗi lọ?
A. Dùng quì tím
B. Dùng dung dịch BaCl2
C. Dùng quì tím và dung dịch BaCl2
D. Dùng quì tím và dung dịch phenol phtalein .
Câu 6: Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn?
A. 1 B. 2 C. 3 D. 4
Câu 7: Oxit vừa tan trong nước vừa hút ẩm là:
A. SO2 B. CaO C. Fe2O3 D. Al2O3
Câu 8: Nguyên liệu chính để sản xuất nhôm là:
A. criolit B. quặng bôxit C. điện D. Than chì
Câu 9: Cặp chất nào sau đây tồn tại trong một dung dịch?
A. NaCl và AgNO3. B. NaOH và K2CO3.
C. Na2SO4 và BaCl2. D. Na2CO3 và H3PO4.
Câu 10: Hiện tượng xảy ra khi cho Al vào ống nghiệm chứa sẵn 2 ml dung dịch NaOH
A. có khí không màu thoát ra, nhôm tan dần.
B. nhôm tan dần, có kết tủa trắng.
C. xuất hiện dung dịch màu xanh.
D. không có hiện tượng xảy ra.
Câu 11: Đồng(II) sunfat là tên gọi của chất có công thức hóa học:
A. CuCl2 B. Cu2O
C. CuS D. CuSO4
Câu 12: Đâu không phải là công thức hóa học của axit
A. HCl B. NH3
C. H3PO4 D. HNO3
Câu 13: Phản ứng nào dưới đây là phản ứng trao đổi?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 + H2
D. BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 14: Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 20,4 B. 1,36 g C. 13,6 g D. 2,04 g
Câu 15: Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 + Ca(OH)2 → Ca(HCO3)2
C. 2NaCl + H2SO4 → Na2SO4 + 2HCl
D. Fe + CuSO4 → FeSO4 + Cu
Câu 16: Nhôm phản ứng được với:
A. Khí clo, dung dịch kiềm, axit, khí oxi.
B. Khí clo, axit, oxit bazơ, khí hiđro.
C. Oxit bazơ, axit, hiđro, dung dịch kiềm.
D. Khí clo, axit, oxi, hiđro, dung dịch magiesunfat.
Câu 17: Để điều chế dung dịch Ba(OH)2, người ta cho:
A. BaO tác dụng với dung dịch HCl
B. BaCl2 tác dụng với dung dịch Na2CO3
C. BaO tác dụng với dung dịch H2O
D. Ba(NO3)2 tác dụng với dung dịch Na2SO4
Câu 18: Cho 2,24 lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH)2, chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
A. 0,5M B. 0,25M C. 0,1M D. 0,05M
Câu 19: Trộn dung dịch có chứa 0,1 mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
A. 8 g B. 4 g C. 6 g D. 12 g
Câu 20: “Ăn mòn kim loại” là sự phá huỷ kim loại do:
A. Tác dụng hoá học của các chất trong môi trường xung quanh.
B. Kim loại phản ứng hoá học với chất khí hoặc hơi nước ở nhiệt độ cao.
C. Kim loại tác dụng với dung dịch chất điện ly tạo nên dòng diện.
D. Tác động cơ học.
Câu 21: Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch NaOH
B. H2O và dung dịch HCl
C. Dung dịch NaOH và H2O
D. Dung dịch CuCl2 và H2O
Câu 22: Phát biểu nào sau đây không đúng?
A. Khi cho sắt tác dụng với dung dịch HCl tạo thành muối và FeCl2
B. Khi cho clo tác dụng với sắt tạo thành muối FeCl3
C. Khi cho clo tác dụng với sắt tạo thành muối FeCl2
D. Khi cho clo tác dụng với FeCl2 tạo thành muối FeCl3
Câu 23: Trung hòa 200ml dung dịch H2SO4 0,1M bằng dung dịch NaOH 10%. Khối lượng dung dịch NaOH cần dùng là:
A. 6g B. 8g C. 10g D. 16g
Câu 24: Dãy phân bón hoá học chỉ chứa toàn phân bón hoá học đơn là:
A. KNO3, NH4NO3, (NH2)2CO
B. KCl, NH4H2PO4, Ca(H2PO4)2
C. (NH4)2SO4, KCl, Ca(H2PO4)2
D. (NH4)2SO4, KNO3, NH4Cl
Câu 25: Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH B. H2SO4, HNO3
C. NaOH, Ca(OH)2 D. BaCl2, NaNO3
Câu 26: Cho 1,66g hỗn hợp gồm Al và Fe tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 1,12 lít khí H2 (đktc). Thành phần % theo khối lượng mỗi kim loại trong hỗn hợp lần lượt là:
A. 32,5% và 67,5% B. 67,5% và 32,5%
C. 55% và 45% D. 45% và 55%
Câu 27: Thả một mảnh nhôm vào ống nghiệm chứa dung dịch CuSO4. Xảy ra hiện tượng:
A. Không có dấu hiệu phản ứng.
B. Có chất rắn màu trắng bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
C. Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
D. Có chất khí bay ra, dung dịch không đổi màu.
Câu 28: Để nhận biết dung dịch axit sunfuric và dung dịch axit clohiđric ta dùng thuốc thử:
A. NaNO3. B. KCl. C. MgCl2. D. BaCl2.
Câu 29: Để nhận biết 2 loại phân bón hoá học là: NH4NO3 và NH4Cl. Ta dùng dung dịch:
A. KOH B. Ca(OH)2 C. AgNO3 D. BaCl2
Câu 30: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al, Zn, Fe B. Zn, Pb, Au
C. Mg, Fe, Ag D. Na, Mg, Al
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I - TRẮC NGHIỆM (7 Điểm)
Câu 1: MgCO3 tác dụng với dung dịch HCl sinh ra:
A. Chất khí cháy được trong không khí
B. Chất khí làm vẫn đục nước vôi trong.
C. Chất khí duy trì sự cháy và sự sống.
D. Chất khí không tan trong nước.
Câu 2: Cặp chất tác dụng với dung dịch axit clohiđric là
A. NaOH, BaCl2 B. NaOH, BaCO3.
C. NaOH, Ba(NO3)2. D. NaOH, BaSO4.
Câu 3: Diêm tiêu có nhiều ứng dụng quan trọng như: Chế tạo thuốc nổ đen, làm phân bón, cung cấp nguyên tố nitơ và kali cho cây trồng, ... Công thức hóa học của diêm tiêu là
A. KCl B. K2CO3 C. KClO3 D. KNO3
Câu 4: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3. Hiện tượng quan sát được là:
A. Có khí thóat ra B. Có kết tủa trắng
C. Có kết tủa đỏ nâu D. Có kết tủa trắng xanh
Câu 5: Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit sunfuric loãng. Thể tích khí hiđro thu được ở đktc là:
A. 44,8 lít B. 4,48 lít C. 2,24 lít D. 22,4 lít
Câu 6: Dung dịch Ba(OH)2 không phản ứng được với:
A. Dung dịch Na2CO3 B. Dung dịch MgSO4
C. Dung dịch CuCl2 D. Dung dịch KNO3
Câu 7: Muối nào dưới đây không bị nhiệt phân hủy
A. KMnO4 B. KClO3 C. KNO3 D. KCl
Câu 8: Cho 4,8 gam kim loại M có hóa trị II vào dung dịch HCl dư, thấy thoát ra 4,48 lít khí hiđro (ở đktc). Vậy kim loại M là:
A. Ca B. Mg C. Fe D. Ba
Câu 9: Hàm lượng sắt trong Fe3O4:
A. 70% B. 72,41% C. 46,66% D. 48,27%
Câu 10: Dung dịch tác dụng được với các dung dịch: Fe(NO3)2, CuCl2 là
A. Dung dịch NaOH B. Dung dịch HCl
C. Dung dịch AgNO3 D. Dung dịch BaCl2
Câu 1: Thứ tự mức độ hoạt động hóa học giảm dần của các kim loại là:
A. Mg, Na, Al, Fe. B. Na, Mg, Al, Fe.
C. Na, Al, Mg, Fe. D. Al, Mg, Fe, Na.
Câu 12: Phát biểu nào sau đây đúng?
A. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
B. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon lớn hơn 5%.
C. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
D. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm lớn hơn 5%.
Câu 13: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần.
Câu 14: Phản ứng nào sau đây là phản ứng trao đổi?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 + H2
D. BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 15: Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng một kim loại:
A. Mg B. Ba C. Cu D. Zn
Câu 16: Nguyên tắc luyện thép từ gang là
A. tăng thêm hàm lượng cacbon trong gang để thu được thép.
B. dùng chất khử CO khử oxit sắt thành sắt ở nhiệt độ cao.
C. dùng CaO hoặc CaCO3 để khử tạp chất Si, P, S, Mn, … trong gang để thu được thép.
D. dùng O2 oxi hóa các tạp chất Si, P, S, Mn, … trong gang để thu được thép.
Câu 17: Trong tất cả các kim loại sau đây, kim loại nào dẫn điện tốt nhất?
A. Vàng (Au) B. Bạc (Ag) C. Đồng (Cu) D. Nhôm (Al)
Câu 18: Phát biểu nào sau đây sai?
A. Phân urê cung cấp nitơ cho cây trồng.
B. Urê có công thức là (NH2)2CO.
C. Supephotphat có Ca(H2PO4)2.
D. Phân lân cung cấp kali cho cây trồng.
Câu 19: Kim loại nào sau đây có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí?
A. Al B. Fe C. Ca D. Na
Câu 20: Hàm lượng sắt trong Fe3O4:
A. 70% B. 72,41% C. 46,66% D. 48,27%
II – TỰ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm) Nhận biết các dung dịch đựng trong các lọ bị mất nhãn: NaOH; AgNO3; H2SO4; K2CO3 bằng phương pháp hóa học.
Câu 2: (2 điểm) Cho 100ml dung dịch Na2CO3 1M tác dụng vừa đủ với 200 gam dung dịch Ba(OH)2.
a) Viết PTHH xảy ra.
b) Tính khối lượng chất kết tủa thu được.
c) Tính nồng độ % của dung dịch Ba(OH)2 dùng cho phản ứng trên.
d) Lọc lấy kết tủa cho vào a gam dung dịch HCl 30%. Tính a sau khi phản ứng hoàn toàn.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Hiện tượng quan sát được khi cho mẩu magie vào ống nghiệm chứa axit HCl dư là:
A. Mẩu Mg tan dần, không có bọt khí thoát ra
B. Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu
C. Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được có màu xanh lam
D. Không xảy ra hiện tượng gì
Câu 2: Từ những chất có sẵn là Na2O, CaO, MgO, CuO, Fe2O3, K2O và H2O, có thể điều chế được bao nhiêu dung dịch bazơ?
A. 1 B. 2 C. 3 D. 4
Câu 3: Trung hòa 300 ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
A. 90 gam B. 100 gam C. 180 gam D. 117 gam
Câu 4: Cho vài giọt dung dịch phenolphtalein không màu vào dung dịch NaOH. Hiện tượng xảy ra là:
A. dung dịch không màu B. dung dịch màu xanh
C. kết tủa trắng D. dung dịch màu hồng
Câu 5: Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím B. HCl C. NaCl D. H2SO4
Câu 6: Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
A. Ca(OH)2, Na2CO3 B. Ca(OH)2, NaCl
C. Ca(OH)2, NaNO3 D. NaOH, KNO3
Câu 7: Phản ứng biểu diễn đúng sự nhiệt phân của muối canxi cacbonat:
Câu 8: Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
A. Dung dịch AgNO3 B. Dung dịch HCl
C. Dung dịch BaCl2 D. Dung dịch Pb(NO3)2
Câu 9: Trong các loại phân bón sau, phân bón hoá học kép là:
A. (NH4)2SO4 B. Ca(H2PO4)2 C. KCl D. KNO3
Câu 10: Phân bón nitrophotka (NPK) là hỗn hợp của
A. (NH4)2HPO4, KNO3 B. (NH4)2HPO4, NaNO3
C. (NH4)3PO4, KNO3 D. NH4H2PO4, KNO3
Câu 11: Kim loại có nhiệt độ nóng chảy thấp nhất là:
A. Hg B. Al C. Fe D. W
Câu 12: Kim loại nhôm bị hòa tan bởi H2SO4 loãng, thu được muối sunfat và khí hiđro. Phản ứng mô tả hiện tượng trên là
A. 2Al + H2SO4 → Al2(SO4)3 + H2
B. 2Al + H2SO4 → Al2SO4 + H2
C. Al + 3H2SO4 → Al(SO4)3 + H2
D. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Câu 13: Chất nào sau đây không phản ứng với dung dịch HCl
A. Fe B. Fe2O3 C. SO2 D. Mg(OH)2.
Câu 14: Nhóm kim loại nào có thể tác dụng với nước ở nhiệt độ thường:
A. Cu, Ca, K, Ba B. Zn, Li, Na, Cu
C. Ca, Mg, Li, Zn D. K, Na, Ca, Ba
Câu 15: Một kim loại có những tính chất (vật lí và hóa học) như sau:
- Hợp kim của nó với các kim loại khác, được ứng dụng trong công nghệ chế tạo máy bay, tên lửa.
- Phản ứng mãnh liệt với axit clohiđric.
- Phản ứng với dung dịch kiềm, giải phóng khí hiđro
- Nhẹ, dẫn điện và dẫn nhiệt tốt. Đó là kim loại:
A. kẽm B. vàng C. nhôm D. chì
Câu 16: Trong công nghiệp người ta điều chế nhôm bằng cách
A. Khử Al2O3 bằng khí CO.
B. Khử Al2O3 bằng khí H2.
C. dùng Na tác dụng với dung dịch AlCl3.
D. điện phân nóng chảy Al2O3/criolit.
Câu 17: Hòa tan a gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 17,92 lít H2 (đktc). Cũng hỗn hợp trên hòa tan hoàn toàn trong dung dịch NaOH dư thu được 13,44 lít H2 (đktc). Giá trị của a là
A. 3,9 B. 7,8 C. 11,7 D. 15,6
Câu 18: Trộn 6,48 gam Al với 16 gam Fe2O3. Thực hiện phản ứng nhiệt nhôm thu được chất rắn A. Khi cho A tác dụng dung dịch NaOH dư thu được 1,344 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm (được tính theo chất thiếu) là
A. 100% B. 85% C. 80% D. 75%
Câu 19: Đốt cháy 1 mol sắt trong oxi, thu được 1 mol sắt oxit. Công thức oxit sắt này là:
A. FeO B. Fe2O3 C. Fe3O4 D. Fe3O2
Câu 20: Ở nhiệt độ cao sắt phản ứng với lưu huỳnh cho:
A. FeS2 B. FeS
C. Fe2S2 D. FeS hoặc FeS2
Câu 21: Để chuyển FeCl3 thành Fe(OH)3, người ta dùng dung dịch:
A. HCl B. H2SO4 C. NaOH D. AgNO3
Câu 22: Trong sản xuất gang, người ta dùng một loại than vừa có vai trò là nhiêu liệu cung cấp nhiệt cho lò cao, vừa tạo ra chất khử CO, vừa tạo thành phần từ 2-5% C trong gang. Loại than đó là:
A. than non B. than đá C. than gỗ D. than cốc
Câu 23: Quặng nào sau đây có hàm lượng Fe cao nhất?
A. Hematit đỏ (Fe2O3). B. Pirit (FeS2).
C. Manhetit (Fe3O4). D. Xiđerit (FeCO3).
Câu 24: Một số hoá chất được để trên ngăn tủ có khung bằng kim loại. Sau một thời gian, người ta thấy khung kim loại bị gỉ. Hoá chất nào dưới đây có khả năng gây ra hiện tượng trên?
A. Ancol etylic. B. Nước cất. C. Dầu hoả. D. Axit clohidric.
Câu 25: Ngâm một lá Zn dư vào 200 ml dung dịch AgNO3 1M. Khi phản ứng kết thúc khối lượng Ag thu được là:
A. 6,5 gam B. 10,8 gam C. 13 gam D. 21,6 gam
Câu 26: Phản ứng không tạo ra muối Fe(III):
A. Fe tác dụng với dung dịch HCl
B. Fe2O3 tác dụng với dung dịch HCl
C. Fe3O4 tác dụng với dung dịch HCl
D. Fe(OH)3 tác dụng với dung dịch H2SO4
Câu 27: X là một oxit sắt. Biết 1,6g X tác dụng vừa hết với 30ml dung dịch HCl 2M. X là oxit nào của sắt?
A. FeO B. Fe2O3
C. Fe3O4 D. Không xác định được
Câu 28: Cho 10,8 g một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4g muối. Kim loại M là:
A. Na B. Fe C. Al D. Mg.
Câu 29: Có 3 dung dịch: NaOH, HCl, H2SO4 có cùng nồng độ mol. Chỉ dùng thêm một chất nào cho dưới đây để nhận biết?
A. Quỳ tím B. Phenolphtalein
C. Dung dịch AgNO3 D. Dung dịch BaCl2
Câu 30: Cho 23g Na tác dụng với 100g nước. Nồng độ phần trăm của dung dịch thu được là:
A. 32,8% B. 23,8% C. 30,8% D. 29,8%
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 6)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Muối nào sau đây không tan.
A. K2SO3 B. Na2SO3 C. CuCl2 D. BaSO4
Câu 2: Axit làm quỳ tím hóa
A. Xanh B. đỏ C. Hồng D. Vàng
Câu 3: Cho 2,7g nhôm vào dung dịch axit clohiđric dư. Thể tích khí hiđro thoát ra (đktc) là:
A. 3,36 lít B. 2,24 lít C. 6,72 lít D. 4,48 lít
Câu 4: Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxit khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
A. Cu B. Fe C. Al D. Na.
Câu 5: Ngâm hỗn hợp gồm các kim loại Al, Cu, Fe trong dung dịch AgNO3 (dư). Người ta thu được
A. Cu B. Ag C. Fe D. cả Cu lẫn Ag
Câu 6: Khi Fe tác dụng với dung dịch H2SO4 loãng, sản phẩm của phản ứng là
A. FeSO4 B. Fe2(SO4)3
C. FeSO4 và H2 D. Fe2(SO4)2 và SO2
Câu 7: Để phân biệt các oxit: Na2O, P2O5, CaO người ta có thể dùng
A. nước và quỳ tím B. dung dịch HCl
C. nước D. quỳ tím khô
Câu 8: Cho Mg và các dung dịch: H2SO4, HCl, NaOH. Số sản phẩm tạo ra (không kể H2O) khi cho các chất đó tác dụng với nhau từng đôi một là:
A. 3 B. 4 C. 5 D. 6
Câu 9: Cho sơ đồ sau: C → X1 → X2 → X3 → Ca(OH)2.
Trong đó X, X2, X3 lần lượt là:
A. CO2, CaCO3, CaO. B. CO, CO2, CaCl2.
C. CO2, Ca(HCO3)2, CaO. D. CO, CaO, CaCl2.
Câu 10: Kim loại X tác dụng với dung dịch H2SO4 cho khí H2. Khí H2 tác dụng oxit kim loại Y cho kim loại Y khi nung nóng. Cặp kim loại X - Y có thể là
A. Zn - Cu B. Cu - Ag C. Ag - Pb D. Cu - Pb
Câu 11: Chất cần dung để điều chế Fe từ Fe2O3 là
A. H2 B. CO2 C. H2SO4 D. Al2O3
Câu 12: Một số hiện tượng quan sát được khi cho mẩu Na vào dung dịch CuSO4:
(1) Cu màu đỏ bám vào mẩu Na
(2) Có kết tủa màu xanh lam xuất hiện
(3) Mẩu Na vo tròn chạy trên bề mặt dung dịch
(4) Na cháy và nổ mạnh
Các hiện tượng đúng
A. (2), (3), (4) B. (1), (3), (4)
C. (1), (2), (4) D. (1), (2), (3)
Câu 13: Để bảo quản kim loại kiềm người ta dùng
A. nước B. rượu
C. dầu hỏa D. dung dịch H2SO4 đặc
Câu 14: Kim loại nào sau đây được dùng để nhận biết cả 4 dung dịch sau: HCl, H2SO4 loãng, CuCl2, CuSO4?
A. Ba B. Mg C. Fe D. Ag
Câu 15: H2SO4 đặc, nguội không tác dụng với
A. Al và Fe B. Mg và Cu C. Zn và Ag D. Cu và Ag
Câu 16: Cho 0,52 gam hỗn hợp hai kim loại tan hoàn toàn trong H2SO4 loãng (dư) thấy có 0,336 lít khí thoát ra (đktc). Khối lượng hỗn hợp muối sunfat khan thu được là
A. 2,0 gam B. 2,4 gam C. 3,92 gam D. 1,96 gam
Câu 17: Nguyên liệu chính để sản xuất nhôm là
A. criolit B. quặng bôxit C. điện D. than chì
Câu 18: Để chống lại sự ăn mòn kim loại người ta thường
1) Để vật nơi khô ráo.
2) Sơn hay bôi dầu mỡ.
3) Phủ một lớp kim loại bền.
4) Chế ra các vật bằng kim loại nguyên chất.
Những biện pháp thích hợp là
A. 1, 2, 3, 4 B. 1, 2, 3 C. 2, 3, 4 D. 1, 3, 4
Câu 19: Đun nóng hỗn hợp gồm 6,4g lưu huỳnh và 1,3g kẽm. Sau phản ứng thu được các chất với khối lượng là (S = 32, Zn = 65)
A. 2,17g Zn và 0,89g ZnS B. 5,76g S và 1,94g ZnS
C. 2,12g ZnS D.7,7g ZnS
Câu 20: Ngâm một lá kẽm (dư) vào trong 200ml dung dịch AgNO3 0,5M. Khi phản ứng kết thúc khối lượng Ag thu được là
A. 8,8 g B. 13 g C. 6,5 g D. 10,8 g
II – TỰ LUẬN (3 điểm)
Câu 1: (1 điểm) Hoàn thành các phương trinh hóa học theo sơ đồ:
NaCl → NaOH → NaHCO3 → Na2CO3 → CaCO3 → CaCl2 → AgCl.
Câu 2: (2 điểm) Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a) Viết các phương trình hóa học xảy ra.
b) Tính khối lượng mỗi chất có trong hỗn hợp ban đầu.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 7)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I - TRẮC NGHIỆM (7 Điểm)
Câu 1: Axit nào sau đây dễ bay hơi.
A. H2SO3 B. H2SO4 C. HCl D. HNO3
Câu 2: Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với:
A. Al, CO2, FeSO4, H2SO4 B. Fe, CO2, FeSO4, H2SO4
C. Al, Fe, CuO, FeSO4 D. Al, Fe, CO2, H2SO4
Câu 3: Kim loại nào sau đây tan được trong dung dịch NaOH?
A. Ag B. Fe C. Cu D. Al
Câu 4: Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 + Ca(OH)2 → Ca(HCO3)2
C. 2NaCl + H2SO4 → Na2SO4 + 2HCl
D. Fe + CuSO4 → FeSO4 + Cu
Câu 5: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
A. Dung dịch NaOH dư B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư D. Dung dịch HNO3 loãng
Câu 6: Tính chất hóa học đặc trưng của kim loại là
A. tác dụng với axit
B. dễ tác dụng với phi kim
C. thể hiện tính khử trong các phản ứng hóa học
D. tác dụng với dung dịch muối
Câu 7: Điểm khác nhau cơ bản giữa gang và thép là
A. do có các nguyên tố khác ngoài Fe và C
B. tỉ lệ của C trong gang từ 2 – 5%, còn trong thép tỉ lệ của C dưới 2%
C. do nguyên liệu để điều chế
D. do phương pháp điều chế
Câu 8: Các cặp sau cặp nào xảy ra phản ứng:
A. Cu + ZnCl2 B. Zn + CuCl2
C. Fe + ZnCl2 D. Zn + ZnCl2
Câu 9: Kim loại Cu có thể phản ứng được với:
A. Dung dịch HCl B. Dung dịch H2SO4 loãng
C. H2SO4 đặc, nóng D. Dung dịch NaOH
Câu 10: KL nào sau dây được dùng để nhận biết cả 3 dd: NaCl, CuCl2, Na2SO4
A. Mg B. Ba C. Fe D. Al
Câu 11: Kim loại nào sau đây tác dụng được với muối CuCl2 và AlCl3?
A. Ag B. Fe C. Zn D. Mg
Câu 12: Cho 12 gam hỗn hợp Fe và Cu vào dung dịch HCl dư thấy thoát ra 2,24 lít khí (đktc) và còn lại m gam chất rắn. Giá trị của m là
A. 6,4 B. 3,2 C. 10,0 D. 5,6
Câu 13: Cho dung dịch AgNO3 vào dung dịch NaCl thì có hiện tượng là:
A. Có bọt khí thoát ra, dung dịch thu được không màu
B. Có xuất hiện kết tủa trắng
C. Dung dịch đổi màu vàng nâu
D. Không có hiện tượng gì xảy ra
Câu 14: Phản ứng hóa học nào sau đây không chính xác:
A. Fe + CuSO4 → FeSO4 + Cu.
B. Fe + 2AgNO3 →Fe(NO3)2 + 2Ag.
C. Cu + MgSO4 → CuSO4 + Mg.
D. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
Câu 15: Kim loại X có đặc điểm:
- Tác dụng với dung dịch HCl, giải phóng H2
- Muối X(NO3)2 hoà tan được Fe.
Trong dãy hoạt động hoá học của kim loại, chọn câu đúng về vị trí của X:
A. Đứng giữa Fe và Cu B. Đứng giữa Fe và H
C. Đứng giữa Fe và Zn D. Đứng giữa Al và Fe
Câu 16: X là kim loại nhẹ, dẫn điện tốt, phản ứng mạnh với dung dịch HCl, tan trong dung dịch kiềm và giải phóng H2. X là:
A. Al B. Mg C. Cu D. Fe
Câu 17: Trong vỏ Trái Đất có nhiều quặng nhôm hơn sắt nhưng giá mỗi tấn nhôm cao hơn nhiều so với giá mỗi tấn sắt. Lí do vì:
A. Chuyển vận quặng nhôm đến nhà máy xử lí tốn kém hơn vận chuyển quặng sắt
B. Nhôm hoạt động mạnh hơn sắt nên để thu hồi nhôm từ quặng sẽ tốn kém hơn
C. Nhôm có nhiều công dụng hơn sắt nên nhà sản xuất có thể có lợi nhuận nhiều hơn
D. Quặng nhôm ở sâu trong lòng đất trong khi quặng sắt từng thấy ngay trên mặt đất
Câu 18: Quặng nào sau đây chứa thành phần chính là Al2O3:
A. Boxit. B. Pirit.
C. Đolomit. D. Apatit.
Câu 19: Cho dây sắt quấn hình lò xo (đã được nung nóng đỏ) vào lọ đựng khí clo. Hiện tượng xảy ra là:
A. Sắt cháy tạo thành khói trắng dày đặt bám vào thành bình
B. Không thấy hiện tượng phản ứng
C. Sắt cháy sáng tạo thành khói màu nâu đỏ
D. Sắt cháy sáng tạo thành khói màu đen
Câu 20: Hòa tan hết 2,8 gam kim loại Fe vào cốc đựng 60 gam dung dịch HCl 7,3% thu được khí H2 và dung dịch X. Nồng độ phần trăm của muối sắt(II) clorua trong dung dịch sau phản ứng là
A. 9,11%. B. 10,03%. C. 10,13%. D. 12,13%.
II – TỰ LUẬN (3 điểm)
Câu 1: (1 điểm) Viết phương trình hóa học và nêu hiện tượng xảy ra khi:
Cho một viên bari (Ba) vào dung dịch đồng(II) sunfat (CuSO4).
Câu 2 (1 điểm): Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, NaOH, Na2SO4, NaCl.
Câu 3: (1 điểm) Ngâm một ít bột sắt dư trong 300 ml dung dịch CuSO4 2M, sau khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Cho chất rắn A tác dụng với dung dịch HCl dư thu được dung dịch X và chất rắn C.
a) Viết các phương trình phản ứng xảy ra và xác định các chất có trong A, B, X và C.
b) Tính khối lượng chất rắn C.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 8)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I - TRẮC NGHIỆM (7 Điểm)
Câu 1: Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn gồm: ZnSO4, Mg(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng:
A. Quì tím B. NaOH C. Ba(OH)2 D. BaCl2
Câu 2: Dung dịch của chất X có pH > 7 và khi cho tác dụng với dung dịch kali sunfat (K2SO4) tạo ra chất không tan (kết tủa). Chất X là:
A. BaCl2 B. NaOH C. Ba(OH)2 D. H2SO4
Câu 3: Cho 1,77 g hỗn hợp Ca và Ba tác dụng hết với nước, sau phản ứng thu được 2,45g hỗn hợp 2 bazơ Ca(OH)2 và Ba(OH)2. Thể tích khí H2 sinh ra ở đktc là:
A. 0,224 lít B. 0,448 lít C. 0,336 lít D. 0,48 lít
Câu 4: Cho cari vào nước được dung dịch A. Cho lượng dư dung dịch Na2CO3 và dung dịch A rồi dẫn tiếp luồng khí CO2 vào đến dư. Hiện tượng nào đúng trong số các hiện tượng sau
A. Sủi bọt khí, xuất hiện kết tủa trắng rồi tan
B. Bari tan, xuất hiện kết tủa trắng, rối tan
C. Bari tan, sủi bọt khí hiđro, đồng thời xuất hiện kết tủa trắng
D. Bari tan, sủi bọt khí hiđro, xuất hiện kết tủa trắng, rồi tan
Câu 5: Trong các kim loại sau, kim loại nào hoạt động mạnh nhất:
A. Cu B. Al C. Pb D. Ba
Câu 6: Chọn mệnh đề đúng:
A. Tất cả các kim loại đều không phản ứng với dung dịch bazơ.
B. Tất cả các kim loại đều không phản ứng với dung dịch axit.
C. Al, Zn phản ứng với dung dịch bazơ
D. Tất cả các mệnh đề trên đều sai.
Câu 7: Tên gọi của Al2O3 và Al(OH)3 lần lượt là:
A. Nhôm oxit và nhôm(III) hiđroxit.
B. Nhôm(III) oxit và nhôm hiđroxit.
C. Nhôm oxit và nhôm hiđroxit.
D. Nhôm(III) oxit và nhôm(III) hiđroxit.
Câu 8: Thí nghiệm 1: Cho 0,3 mol Fe vào dung dịch H2SO4 loãng.
Thí nghiệm 2: Cho 0,3 mol Fe vào trong dung dịch H2SO4 đặc nóng thoát ra khí SO2 (sản phẩm khử duy nhất).
Tỉ lệ mol khí thoát ra ở hai thí nghiệm là:
A. 1:3 B. 2:3 C. 1:1 D. 1: 1,2
Câu 9: Clo hoá11,2g Fe ở nhiệt độ cao thu được m gam muối. Giá trị của m là
A. 48,75 B. 40,5 C. 24,375 D. 32,5
Câu 10: Một tấn quặng manhetit chứa 81,2% Fe3O4. Khối lượng Fe có trong quặng là:
A. 858 kg B. 885 kg C. 588 kg D. 724 kg
Câu 11: Hoà tan 9 g hợp kim nhôm – magie vào dung dịch H2SO4 dư thu được 10,08 lít khí H2 (đktc). Thành phần % khối lượng của Al và Mg trong hợp kim lần lượt là:
A. 50% và 50% B. 40% và 60%
C. 60% và 40% D. 39% và 61%
Câu 12: Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,36 lít H2 (đktc). Kim loại là:
A. Zn. B. Mg. C. Fe. D. Ca.
Câu 13: Ngâm 1 lá Zn vào dung dịch CuSO4 sau 1 thời gian lấy lá Zn ra thấy khối lượng dung dịch tăng 0,2 g. Vậy khối lượng Zn phản ứng là
A. 0,2 g B. 13 g C. 6,5 g D. 0,4 g
Câu 14: Cho 13g hỗn hợp A gồm Cu, Al, Mg vào dung dịch HCl dư, phản ứng xong thu được 4 gam chất rắn không tan và 10,08 lít khí H2 (đktc). Tính thành phần phần trăm theo khối lượng của từng kim loại trong hỗn hợp.
A. 30,77%; 27,69%; 41,54% B. 27,69%; 41,54%; 30,77%
C. 30,77%; 41,54%; 27,69% D. 27,69%; 30,77%;41,54%
Câu 15: Hoà tan 5,2g hỗn hợp gồm Mg và Fe bằng dung dịch axit HCl 1M, thì thu được 3,36 lit H2 (đktc). Tính thể tích dung dịch axit HCl đã dùng.
A. 200 ml B. 300 ml C. 400 ml D. 500 ml
Câu 16: Các dụng cụ như: cuốc, xẻng, dao, búa, … khi lao động xong con người ta phải lau, chùi (vệ sinh) các thiết bị này. Việc làm này nhằm mục đích
A. thể hiện tính cẩn thận của người lao động.
B. làm các thiết bị không bị gỉ.
C. để cho mau bén.
D. để sau này bán lại không bị lỗ.
Câu 17: Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng:
A. ZnO, BaCl2 B. CuO, BaCl2
C. BaCl2, Ba(NO3)2 D. Ba(OH)2, ZnO
Câu 18: Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong bình khí clo dư
(2) Cho Fe vào dung dịch HNO3 đặc, nguội
(3) Cho Fe vào dung dịch HCl loãng, dư
(4) Cho Fe vào dung dịch H2SO4 loãng, dư
(5) Cho Fe vào dung dịch H2SO4 đặc, nóng
Số thí nghiệm tạo ra muối Fe(II) là:
A. 3 B. 4 C. 2 D. 1
Câu 19: Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl. B. K2SO4 và NaCl.
C. Na2SO4 và CuCl2 D. Na2SO3 và H2SO4
Câu 20: Khối lượng của nguyên tố N có trong 200 g (NH4)2SO4 là
A. 42,42 g B. 21,21 g C. 24,56 g D. 49,12 g
II – TỰ LUẬN (3 điểm)
Câu 1: (1 điểm) Thả một mảnh Cu vào các ống nghiệm có chứa các dung dịch sau:
a) AgNO3
b) H2SO4 loãng
c) H2SO4 đăc, nóng
d) MgSO4.
Em hãy cho biết hiện tượng xảy ra trong các trường hợp trên. Viết phương trình hóa học nếu có.
Câu 2: (2 điểm) Cho một khối lượng mạt sắt dư vào 100 ml dung dịch HCl. Phản ứng xong, thu được 6,72 lít khí (đktc).
a) Viết phương trình hóa học.
b) Tính khối lượng mạt sắt đã tham gia phản ứng.
c) Tìm nồng độ mol của dung dịch HCl đã dùng.