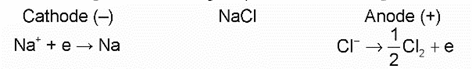Lý thuyết Hóa học 12 Bài 13: Điện phân - Chân trời sáng tạo
Haylamdo biên soạn tóm tắt lý thuyết Hóa 12 Bài 13: Điện phân sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa 12 Bài 13: Điện phân - Chân trời sáng tạo
I. ĐIỆN PHÂN NÓNG CHẢY, ĐIỆN PHÂN DUNG DỊCH
Điện phân là quá trình oxi hoá - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
1. Nguyên tắc điện phân nóng chảy
- Nguyên tắc:
+ Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
+ Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
- Ví dụ: Điện phân nóng chảy NaCl:
+ Khi nóng chảy, NaCl phân li thành ion: NaCl → Na+ + Cl-.
+ Khi dòng điện một chiều có hiệu điện thế phù hợp đi qua NaCl nóng chảy, ion Cl- di chuyển về cực dương, ion Na+ di chuyển về cực âm.
Ở cực âm (cathode) xảy ra quá trình khử ion Na+:
Na+ + e→ Na
Ở cực dương (anode) xảy ra quá trình oxi hoá ion Cl-:
Quá trình điện phân NaCl nóng chảy có thể biểu diễn qua sơ đồ sau:
Phương trình hoá học của quá trình điện phân NaCl nóng chảy:
2. Nguyên tắc điện phân dung dịch
- Nguyên tắc: Nguyên tắc điện phân dung dịch:
+ Ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn;
+ Ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
Chú ý: Khi điện phân dung dịch, ngoài các ion của chất điện phân, còn có sự tham gia của dung môi H2O.
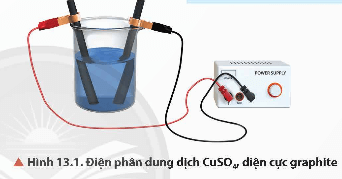
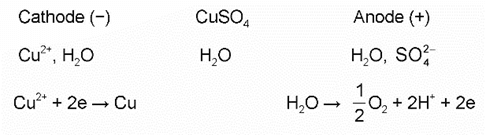
- Ví dụ: Điện phân dung dịch CuSO4, điện cực graphite (than chì)
+ Ở cathode có thể xảy ra sự khử ion Cu2+ hoặc H2O. Tuy nhiên, ion Cu2+ dễ bị khử hơn H2O nên Cu2+ được ưu tiên điện phân trước:
Cu2+ + 2e → Cu
+ Ở anode có thể xảy ra sự oxi hoá ion hoặc H2O. Tuy nhiên, H2O dễ bị oxi hoá hơn nên H2O được ưu tiên điện phân trước:
Sơ đồ điện phân:
Phương trình hóa học của phản ứng điện phân:
II. ỨNG DỤNG
Hiện tượng điện phân có nhiều ứng dụng trong thực tiễn sản xuất và đời sống như luyện kim, tinh chế kim loại, mạ điện,...Ví dụ:
+ Kim loại nhôm được sản xuất trong công nghiệp bằng phương pháp điện phân nóng chảy aluminium oxide (Al2O3), điện cực than chì, khi có mặt cryolite (Na3AlF6) nóng chảy.
+ Phương pháp điện phân với anode tan được dùng để tinh chế một số kim loại như Cu, Ag,...Phương phápnày cũng được sử dụng trong kĩ thuật mạ điện nhằm mục đích bảo vệ kim loại không bị ăn mòn và làm chúng trở nên sáng bóng, đẹp với lớp mạ rất mỏng. Trong kĩ thuật mạ điện, anode là kim loại dùng để mạ (như Ag, Cu, Au, Cr, Ni, Sn, ...) và cathode là vật cần mạ.