Bài tập về Hòa tan kim loại và chất rắn vào dung dịch axit lớp 8 có lời giải
Bài tập về Hòa tan kim loại và chất rắn vào dung dịch axit lớp 8 có lời giải
Haylamdo biên soạn và sưu tầm 13 bài tập trắc nghiệm về Hòa tan kim loại và chất rắn vào dung dịch axit môn Hóa học lớp 8 chọn lọc, có lời giải chi tiết đầy đủ câu hỏi lý thuyết và các dạng bài tập sẽ giúp học sinh có thêm bài tập tự luyện từ đó học tốt môn Hóa học lớp 8 hơn.

Câu 1: Cho 16,8 gam Fe vào 200 gam dung dịch HCl 12,775%, phản ứng hoàn toàn thu được dung dịch A và V lít H2 (đktc). Giá trị của V là
A. 6,72 lít.
B. 4,48 lít.
C. 2,24 lít.
D. 1,12 lít.
Lời giải:
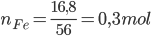
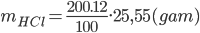
PTHH: Fe + 2HCl → FeCl2 + H2 ↑
Xét tỉ lệ: 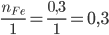 và
và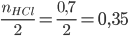
Ta thấy: 0,3 < 0,35 => Fe phản ứng hết, HCl còn dư => tính toán theo số mol Fe
Theo PTHH: nH2=nFe=0,3mol=>VH2=0,3.22,4=6,72 lít
Đáp án cần chọn là: A
Câu 2: Cho 5,4 gam Al vào dung dịch chứa 400 gam H2SO4 9,8%, phản ứng hoàn toàn thu được dung dịch A và khí H2. Khối lượng dung dịch A là
A. 405,4 gam
B. 400 gam.
C. 404,8 gam.
D. 412,4 gam.
Lời giải:
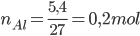
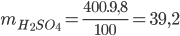
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑
Xét tỉ lệ: 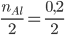 và
và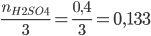
Vì 0,1 < 0,133 => Al phản ứng hết, H2SO4 còn dư
=> tính toán theo số mol Al
Theo PTHH: nH2=32.nAl=32.0,2=0,3 mol
Vì phản ứng sinh ra khí H2 => mdd sau pứ =mdd A=mAl+mdd H2SO4−mH2=mdd A=mAl+mdd H2SO4−mH2
=> mdd A = 5,4 + 400 – 0,3.2 = 404,8 gam
Đáp án cần chọn là: C
Câu 3:: Cho 9,75 gam Zn vào dung dịch chứa 100 gam HCl 9,125%, phản ứng kết thúc thu được dung dịch A và V lít khí H2 (đktc). Nồng độ phần trăm của muối trong dung dịch A là
A. 15,52%
B. 15,76%
C. 15,72%
D. 16,01%
Lời giải:
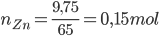
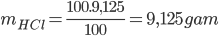
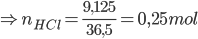
PTHH: Zn + 2HCl → ZnCl2 + H2 ↑
Xét tỉ lệ: 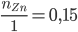 và
và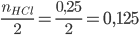
Vì 0,15 > 0,125 => Zn còn dư, HCl phản ứng hết
=> tính theo số mol HCl:
Theo PTHH: nZnCl2 = nH2 =![]() nHCl =
nHCl =![]() = 0,125mol
= 0,125mol
nZn phản ứng = ![]() nHCl=
nHCl=![]() =0,125mol
=0,125mol
Vì lượng Zn dư không nằm trong dung dịch và khí H2 sinh ra bay khỏi dung dịch
=> mdd sau pứ = mZn phản ứng + mdd HCl – mH2= 0,125.65 + 100 – 0,125.2 = 107,875 gam
Đáp án cần chọn là: B
Câu 4: Cho 11,2 gam bột Fe vào 500 ml dung dịch HCl 1,2 M, phản ứng hoàn toàn thu được V lít khí H2 ở đktc.Giá trị của V là
A. 4,48 lít.
B. 6,72 lít.
C. 8,96 lít.
D. 2,24 lí
Lời giải:
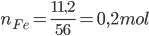 nHCl = CM . V = 0,5.1,2 = 0,6 mol
nHCl = CM . V = 0,5.1,2 = 0,6 mol
PTHH: Fe + 2HCl → FeCl2 + H2
Xét tỉ lệ: 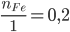 <
< 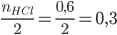
=> Fe phản ứng hết, HCl còn dư => tính toán theo số mol Fe
Theo PTHH: nH2=nFe=0,2mol
⇒VH2=0,2.22,4=4,48 lít
Đáp án cần chọn là: A
Câu 5: Cho 8,1 gam bột Al vào 600 ml dung dịch HCl 1,25 M, phản ứng hoàn toàn thu được khí H2 và dung dịch A. Coi thể tích dung dịch thay đổi không đáng kể. Tính CM của chất tan trong dung dịch A
A. 0,833M.
B. 0,25M.
C. 0,5M.
D. 0,4167M
Lời giải:
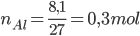
nHCl = 0,6.1,25 = 0,75 mol
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Xét tỉ lệ: 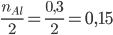 >
>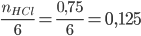
=> Al dư, HCl phản ứng hết, tính toán theo số mol HCl
=> chất tan trong dung dịch A chỉ gồm AlCl3
Theo PTHH:nAlCl3=![]() .nHCl=
.nHCl=![]() .0,75=0,25mol
.0,75=0,25mol
Vì thể tích dung dịch thay đổi không đáng kể => Vdd sau pứ = Vdd HCl bđầu = 600 ml = 0,6 lít
=>CMAlCl3=![]() =
=![]() =0,416
=0,416
Đáp án cần chọn là: D
Chú ý
tính nhầm số mol AlCl3 theo số mol Al => chọn nhầm C
Câu 6: Cho 3,6 gam Mg vào 400 ml dung dịch HCl vừa đủ (D = 1,125 g/ml), phản ứng hoàn toàn thu được V lít khí H2 (ở đktc) và dung dịch A. Giả thiết thể tích của dung dịch sau phản ứng thay đổi không đáng kể. Nồng độ phần trăm của chất tan trong dung dịch A.
A. 3,58%.
B. 3,14%
C. 5,56%.
D. 4,65%
Lời giải:
nMg=![]() =0,15 mol
=0,15 mol
PTHH: Mg + 2HCl → MgCl2 + H2
Theo PTHH:nMgCl2=nH2=nFe=0,15mol
Khối lượng dung dịch HCl đã dùng là: mdd HCl = D . V = 1,125 . 400 = 450 gam
Vì sau phản ứng có khí H2 bay ra => mdd sau pứ = mMg + mdd HCl – mH2 = 3,6 + 450 – 0,15.2 = 453,3 gam
Dung dịch A chỉ chứa MgCl2
=> Nồng độ dung dịch MgCl2 là: 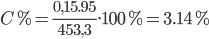
Đáp án cần chọn là: B
Câu 7: Cho 5,6 gam Fe vào 200 ml dung dịch HCl 1,5 M (D = 1,25 g/ml), phản ứng hoàn toàn thu được khí H2 và dung dịch A. Giả thiết thể tích của dung dịch sau phản ứng thay đổi không đáng kể. Nồng độ phần trăm của các chất tan trong dung dịch A là
A. 4,97% và 1,43%.
B. 5,12% và 1,43%.
C. 4,97% và 5,12%.
D. 2,44% và 5,12%
Lời giải:
nFe=![]() mol
mol
nHCl = 0,2.1,5 = 0,3 mol
PTHH: Fe + 2HCl → FeCl2 + H2
Xét tỉ lệ: 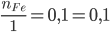 <
<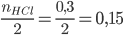
=> Fe phản ứng hết, HCl còn dư => Dung dịch A gồm FeCl2 và HCl dư
Theo PTHH:nFeCl2 =nH2 = nFe=0,1mol
nHCl phản ứng = 2.nFe = 2.0,1 = 0,2 mol => nHCl dư = 0,3 – 0,2 = 0,1 mol
mdd HCl ban đầu = D . V = 1,25.200 = 250 (gam)
Vì Fe phản ứng hết và sau phản ứng có khí H2 sinh ra
=> mdd sau pứ = mFe + mdd HCl ban đầu – mH2 = 5,6 + 250 – 0,1.2 = 255,4 gam
⇒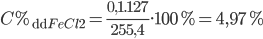
⇒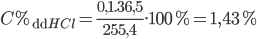
Đáp án cần chọn là: A
Câu 8: Hòa tan hoàn toàn kim loại M bằng dung dịch HCl 14,6% vừa đủ thu được dung dịch A chỉ chứa muối clorua của M có nồng độ 22,92%. Kim loại M là
A. Mg.
B. Fe.
C. Al.
D. Zn
Lời giải:
Vì đầu bài chỉ cho nồng độ phần trăm các chất mà không cho số mol cụ thể nên ta có thể giả sử lấy 1 mol kim loại M để thuận tiện tính toán.
Gọi kim loại M có hóa trị n (n = 1, 2, 3, 4)
PTHH: 2M + 2nHCl → 2MCln + nH2 ↑
P/ứng: 1 mol → n mol → 1 mol → 0,5n mol
=> Khối lượng HCl phản ứng là: mHCl = 36,5.n (gam)
=> mdd HCl = 36,5.n.10014,6=250n (gam)
Khối lượng muối MCln thu được là: mMCln=M+35,5.n (gam)
Phản ứng sinh ra khí H2 => mdd sau pứ = mM + mdd HCl – mH2 = M + 250n – 0,5.n.2 = M + 249.n (gam)
=> Nồng độ phần trăm của muối clorua thu được là:
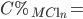
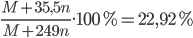
=> M + 35,5.n = 0,2292.(M + 249n) => M = 28n
Xét bảng giá trị:

Vậy kim loại M cần tìm là Fe
Đáp án cần chọn là: B
Câu 9: Hòa tan hoàn toàn kim loại R bằng dung dịch H2SO4 24,5% vừa đủ thu được dung dịch muối sunfat của R có nồng độ 27,4%. Kim loại R là
A. Mg.
B. Fe.
C. Al.
D. Zn
Lời giải:
Vì đầu bài chỉ cho nồng độ phần trăm các chất mà không cho số mol cụ thể nên ta có thể giả sử lấy 1 mol kim loại R để thuận tiện tính toán.
Gọi kim loại R có hóa trị n (n = 1, 2, 3, 4)
PTHH: 2R + nH2SO4 → R2(SO4)n + nH2 ↑
P/ứng: 1 mol → 0,5.n mol → 0,5 mol → 0,5.n mol
=> Khối lượng H2SO4 phản ứng là: mH2SO4 = 0,5.n.98 = 49.n(gam)
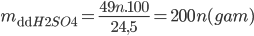
Khối lượng muối R2(SO4)n thu được là: mR2(SO4)n = 0,5.(2R+96.n) = R+48n (gam)
Phản ứng sinh ra khí H2 => mdd sau pứ = mR + mdd HCl – mH2 = R + 200n – 0,5.n.2 = M + 199.n (gam)
=> Nồng độ phần trăm của muối sunfat thu được là:
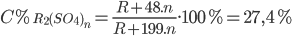
=> R + 48.n = 0,274.(R + 199n) => R = 9n
Xét bảng giá trị:

Vậy kim loại R là Al
Đáp án cần chọn là: C
Câu 10: Hòa tan 10,4 gam hỗn hợp X (Mg, Fe) bằng dung dịch HCl dư thì thấy sinh ra 6,72 lít khí H2 (đktc). Tính khối lượng của mỗi kim loại có trong hỗn hợp X
A. 4,8 gam và 5,6 gam.
B. 2,4 gam và 11,2 gam.
C. 2,4 gam và 8 gam.
D. 3,6 gam và 6,8 gam.
Lời giải:
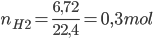
Gọi số mol của Mg và Fe trong hỗn hợp X lần lượt là x và y mol
=> mhỗn hợp X = mMg + mFe => 24x + 56y = 10,4 (I)
PTHH: Mg + 2HCl → MgCl2 + H2 ↑ (1)
P/ứng: x mol → 2x mol → x mol → x mol
PTHH: Fe + 2HCl → FeCl2 + H2 ↑ (2)
P/ứng: y mol → 2y mol → y mol → y mol
⇒∑nH2(sinhra)=nH2(1)+nH2(2)⇒x+y=0,3(II)
Từ (I) và (II), ta có hệ phương trình: 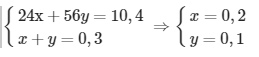
=> Khối lượng của Mg trong hỗn hợp X là: mMg = 0,2.24 = 4,8 gam
Khối lượng của Fe trong hỗn hợp X là: mFe = 0,1.56 = 5,6 gam
Đáp án cần chọn là: A
Câu 11: Cho 11 gam hỗn hợp X gồm (Fe, Al) vào 500 gam dung dịch H2SO4 9,8%, sau khi các phản ứng kết thúc thấy thoát ra 8,96 lít khí H2 ở đktc. Chất nào dư và dư bao nhiêu gam?
A. Fe dư, dư 2 gam.
B. H2SO4 dư, dư 4,9 gam
C. H2SO4 dư, dư 9,8 gam.
D. Al dư, dư 3 gam.
Lời giải:
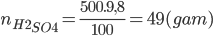
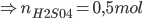
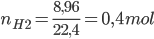
PTHH: Fe + H2SO4 → FeSO4 + H2 ↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑
Từ 2 PTHH, ta nhận thấy số mol H2 sinh ra đúng bằng số mol H2SO4 phản ứng
=> nH2SO4phản ứng = NH2= 0,4 mol < nH2SO4ban đầu
=> H2SO4 còn dư
nH2SO4dư =nH2SO4ban đầu -nH2SO4phản ứng = 0,5 – 0,4 = 0,1 mol
=> mH2SO4dư = 0,1.98 = 9,8 gam
Đáp án cần chọn là: C
Câu 12: Cho 15,15 gam hỗn hợp A gồm (Zn, Al) vào 200 gam dung dịch HCl 21,9%, sau khi các phản ứng kết thúc thấy thoát ra 10,08 lít khí H2 ở đktc. Nồng độ phần trăm của muối ZnCl2 trong dung dịch thu được sau phản ứng làA. 9,48%.
B. 9,52%.
C. 8,18%.
D. 9,25%
Lời giải:
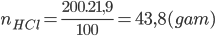
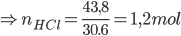
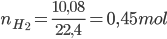
PTHH:
Zn + 2HCl → ZnCl2 + H2 ↑ (1)
2Al + 6HCl → 2AlCl3 + 3H2 ↑ (2)
Từ 2 PTHH, ta nhận thấy số mol HCl phản ứng gấp đôi số mol H2 sinh ra
=> nHCl phản ứng = 2.nH2= 2.0,45 = 0,9 mol
Nhận thấy: nHCl phản ứng < nHCl ban đầu => HCl còn dư, kim loại phản ứng hết
=> tính số mol ZnCl2 theo số mol Zn
Gọi số mol Zn và Al lần lượt là x và y mol
=> mhỗn hợp A = mZn + mAl => 65x + 27y = 15,15 (I)
Từ PTHH (1): 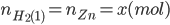
Từ PTHH (2): 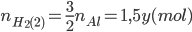
⇒nH2sinhra=nH2(1)+nH2(2)⇒x+1,5y=0,45(II)
Từ (I) và (II) ta có hệ PT:
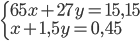
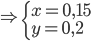
Theo PTHH(1): nZnCl2=nZn=0,15mol=>mZnCl2=0,15.136=20,4(gam)
Vì sau phản ứng sinh ra khí H2 => mdd sau pứ = mKL + mdd HCl bđầu – mH2 = 15,15 + 200 – 0,45.2 = 214,25 gam
=> Nồng độ dd ZnCl2 là:
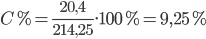
Đáp án cần chọn là: B
Câu 13: Hòa tan hoàn toàn một muối cacbonat của kim loại R bằng dung dịch HCl 18,25% vừa đủ, sau phản ứng thu được dung dịch muối clorua có nồng độ 21,591%. Công thức hóa học của muối cacbonat là
A. CuCO3.
B. FeCO3.
C. MgCO3.
D. CaCO3.
Lời giải:
Gọi kim loại R có hóa trị n (n = 1, 2, 3, 4) => Muối cacbonat của R có dạng R2(CO3)n
Giả sử lấy 1 mol R2(CO3)n => mR2(CO3)n=2R+60n(gam)
PTHH: R2(CO3)n + 2nHCl → 2RCln + nCO2 ↑ + nH2O
P/ứng: 1 mol → 2n mol → 2 mol → n mol
=> Khối lượng HCl phản ứng là: mHCl = 36,5 . 2n = 73n (gam)
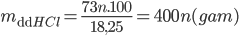
Khối lượng muối RCln thu được là: mRCln=2.(R+35,5n)=2R+71n(gam)
Khối lượng khí CO2 sinh ra là: mCO2=44n(gam)
Vì phản ứng sinh ra khí CO2=> mdd sau pứ = mR2(CO3)n+mddHCl−mCO2= 2R + 60n + 400n – 44n = 2R + 416n (gam)
=> Nồng độ muối thu được là : 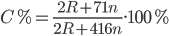
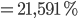
=> 2R + 71n = 0,21591.(2R + 416n)
=> R = 12n
Xét bảng giá trị :

Vậy R là kim loại Mg => muối cacbonat của R là MgCO3
Đáp án cần chọn là: C

