2Ag + S → Ag2S - Cân bằng phương trình hoá học
Phản ứng hoá học:
2Ag + S → Ag2S
Điều kiện phản ứng
- Không có điều kiện
Cách thực hiện phản ứng
- Cho kim loại bạc tác dụng với lưu huỳnh
Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa màu đen
Bạn có biết

Ví dụ minh họa
Ví dụ 1: Trong các phản ứng sau đây phản ứng nào tạo kết tủa màu đen ?
A. 2Ag + I2 → 2AgI ↓
B. 2Ag + Br2 → 2AgBr ↓
C. 2Ag + Cl2 → 2AgCl ↓
D. 2Ag + S → Ag2S ↓
Đáp án: D
Ví dụ 2: Cho 10,8 g bạc tác dụng với 3,2 g lưu huỳnh thì thu được m g kết tủa . Gía trị của m là:
A. 9,92g B. 6,2g
C. 12,4 g D. 14,88 g
Hướng dẫn:
2Ag + S → Ag2S ↓
Ta có: nAg = 10,8/108 = 0,1 mol; nS = 3,2/32 = 0,1 mol
Theo phương trình: nS = 1/2 . nAg = 1/2 . 0,1 = 0,05 mol < 0,1 mol → nS dư
→ nAg2S = nAg = 0,05 mol → mAg2S = 0,05.248 = 12,4 g
Đáp án: C
Ví dụ 3: Cho 1,72 g hỗn hợp kim loại X gồm Cu , Ag( theo tỉ lệ mol 1:1) tác dụng với lưu huỳnh thì thu được a g kết tủa . Giá trị của a là:
A. 1,43g B. 2,2g
C. 1,7 g D. 2,96 g
Hướng dẫn:
Đặt x = nCu mol; y = nAg mol
Theo bài ra ta có:
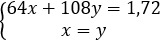
→ x = y = 0,01 mol
2Ag + S → Ag2S ↓ (1)
0,01 mol → 0,005 mol
Cu + S → CuS ↓ (2)
0,01 mol → 0,01 mol
→ a = mAg2S + mCuS = 0,005.248 + 0,01.96 = 2,2 g
Đáp án: B

