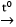2Al + 3H2SO4(loãng) → Al2(SO4)3 + 3H2 - Cân bằng phương trình hoá học
Phản ứng hoá học:
2Al + 3H2SO4(loãng) → Al2(SO4)3 + 3H2
Điều kiện phản ứng
- Điều kiện bình thường.
- Tốc độ phản ứng xảy ra nhanh hơn ở nhiệt độ cao.
Cách thực hiện phản ứng
- Cho Al phản ứng với dung dịch axit H2SO4 tạo muối nhôm sunfat và có khí H2 bay ra.
Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm Al và sủi bọt khí không màu.
Bạn có biết
Tương tự Al, các kim loại khác đứng trước Hiđro trong dãy điện hoá có phản ứng với dung dịch axit H2SO4 loãng tạo muối sunfat và có khí H2 bay ra.

Ví dụ minh họa
Ví dụ 1:Cho Al tác dụng với lần lượt các dung dịch axit sau: HCl; HNO3 loãng; H2SO4 đặc, nóng; HNO3 đặc, nguội; H2SO4 loãng. Số dung dịch có thể hòa tan được Al là:
A. 3. B. 2. C. 5. D. 4.
Hướng dẫn giải
Chọn D.
Al phản ứng với HCl; HNO3 loãng; H2SO4 đặc, nóng; H2SO4 loãng.
2Al + 6HCl(l) → 2AlCl3 + 3H2 ;
Al + 3H2SO4(l) → Al2(SO4)3 + 3H2.
Al + 4HNO3 loãng → Al(NO3)3 + NO + 2H2O
2Al + 6H2SO4 đặc, nóng → Al2(SO4)3 + 3SO2 + 3H2O
Lưu ý: Al bị thụ động hóa bởi HNO3 đặc, nguội
Ví dụ 2:cho các phản ứng sau:
(1) Sn + HCl loãng →
(2) FeS + H2SO4 (loãng) →
(3) MnO2 + HCl đặc
(4) Cu + H2SO4 đặc
(5) Al + H2SO4 loãng →
(6) FeSO4 + KMnO4 + H2SO4 →
Số phản ứng mà H+ của acid đóng vai trò chất oxi hóa là:
A. 3 B. 5 C. 2 D. 6
Hướng dẫn giải
Chọn C.
(1) Sn + 2HCl loãng → SnCl2 + H2
(5) 2Al + 6H2SO4 loãng → Al2(SO4)3 + 3H2
Ví dụ 3:Trong 4 phương trình dưới đây, phương trình nào H2SO4 thể hiện tính oxi hóa?
A. Al + H2SO4 → Al2(SO4)3 + H2↑.
B. Al2O3 + H2SO4 → Al2(SO4)3 + 3H2O.
C. CaCO3 + H2SO4 → CaSO4 + CO2↑ + H2O.
D. 2NaOH + H2SO4 → Na2SO4 + 2H2O
Hướng dẫn giải
Chọn A.
A đúng, H+ +2e → H2 ⇒ H2SO4 thể hiện tính oxi hóa.