2Al + 6HCl → 2AlCl3 + 3H2 - Cân bằng phương trình hoá học
Phản ứng hoá học:
2Al + 6HCl → 2AlCl3 + 3H2
Điều kiện phản ứng
- Điều kiện bình thường.
- Tốc độ phản ứng xảy ra nhanh hơn ở nhiệt độ cao.
Cách thực hiện phản ứng
- Cho Al phản ứng với dung dịch axit HCl tạo muối nhôm clorua và có khí H2 bay ra.
Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm Al và sủi bọt khí không màu.
Bạn có biết
Tương tự Al, các kim loại khác đứng trước Hiđro trong dãy điện hoá có phản ứng với dung dịch axit HCl tạo muối clorua và có khí H2 bay ra.

Ví dụ minh họa
Ví dụ 1:Phát biểu nào sau đây là đúng?
A. Nhôm và crom đều phản ứng với dung dịch HCl theo cùng tỉ lệ số mol.
B. Hỗn hợp gồm Ba(NO3)2 và NaHCO3 có thể tan hoàn toàn trong nước dư.
C. Chỉ dùng dung dịch NaOH để phân biệt được hỗn hợp gồm Mg, Al2O3 và MgO.
D. Cr(III) oxit tan được trong dung dịch NaOH loãng ở nhiệt độ thường.
Hướng dẫn giải
Chọn B.
A sai, 2Al + 6HCl → 2AlCl3 + 3H2; 2Cr + 2HCl → CrCl2 + H2.
C sai, Al2O3 tan trong NaOH còn Mg, MgO thì không tan trong NaOH → Không phân biệt được.
D sai, Cr(III) oxit tan được trong dung dịch NaOH đặc, nóng.
Ví dụ 2:Cho các phản ứng sau:
(1). 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
(2). HCl + NH4HCO3 → NH4Cl + CO2 + H2O
(3). 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O
(4). 2HCl + Zn → ZnCl2 + H2
(5). 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
(6). 2HCl + Fe → FeCl2 + H2.
(7). 14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
(8). 6HCl + 2Al → 2AlCl3 + 3H2.
(9). 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số phản ứng trong đó HCl thể hiện tính oxi hóa, và số phản ứng HCl thể hiện tính khử là bao nhiêu?
Hướng dẫn giải
5 phản ứng HCl thể hiện tính khử, 3 phản ứng HCl thể hiện tính oxi hóa.
HCl thể hiện tính khử khi có khí Cl2 bay ra bao gồm các phản ứng:
(3). 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O
(9). 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
(5). 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
(7). 14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
(1). 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
HCl thể hiện tính oxi hóa khi có khí H2 bay ra bao gồm:
(4). 2HCl + Zn → ZnCl2 + H2
(8). 6HCl + 2Al → 2AlCl3 + 3H2.
(6). 2HCl + Fe → FeCl2 + H2.
Ví dụ 3:Cho 5,4 gam Al hòa tan trong dung dịch axit HCl dư thu được V lít khí H2. Hỏi giá trị V bằng bao nhiêu?
A. 1,12 lit.
B. 2,24 lit.
C. 3,36 lit.
D. 6,72 lit.
Hướng dẫn giải
Chọn D.
nAl =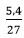
6HCl + 2Al → 2AlCl3 + 3H2
0,2 ---------------→ 0,3
⇒ VH2=0,3.22,4=6,72 lit.

