Al2O3 + 2NaOH → 2NaAlO2 + H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Điều kiện phản ứng
- Điều kiện thường.
Cách thực hiện phản ứng
- Cho Al2O3 phản ứng với dung dịch kiềm NaOH muối nhôm aluminat và nước.
Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm oxit tạo dung dịch trong suốt.
Bạn có biết
- ZnO, Cr2O3 cũng có khả năng hòa tan trong dung dịch kiềm NaOH, riêng Cr2O3 tan trong dung dịch kiềm đặc nóng.

Ví dụ minh họa
Ví dụ 1:Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HCl.
(b) Cho Al2O3 vào dung dịch NaOH loãng dư.
(c) Cho dung dịch FeCl2 vào dung dịch NaOH dư.
(d) Cho Ba(OH)2 vào dung dịch K2SO4.
Sau khi kết thúc phản ứng, số thí nghiệm thu được chất rắn là:
A. 2. B. 1. C. 4. D. 3.
Hướng dẫn giải
Chọn D.
(a) AgNO3 + HCl → AgCl↓ + HNO3
(b) Al2O3 + 2NaOH → 2NaAlO2 + H2O
(c) FeCl2 + NaOH → Fe(OH)2↓ + 2NaCl
(d) Ba(OH)2 + K2SO4 → BaSO4↓ + 2KOH
Ví dụ 2:Cho 15,6 gam hỗn hợp X gồm Al và Al2O3 tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2. Khối lượng Al2O3 trong X là
A. 5,4 gam.
B. 5,1 gam.
C. 10,2 gam.
D. 2,7 gam.
Hướng dẫn giải
Chọn C.
2Al + 2NaOH + 2 H2O → 2NaAlO2 + 3 H2↑ (1)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
nH2=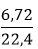
Theo phương trình (1) có nAl=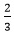
⇒ mAl=0,2.27=5,4 gam ⇒ mAl2O3=15,6-5,4=10,2 gam
Ví dụ 3:Cho các phản ứng hóa học sau:
1. H2S+ SO2 →
2. Ag + O3 →
3. Na2SO3 + H2SO4 loãng →
4. SiO2+ Mg →
5. SiO2 + HF →
6. Al2O3 + NaOH →
7. H2O2 + Ag2O →
8. Ca3P2 + H2O →
Số phản ứng oxi hóa khử là:
A. 4 B. 6 C. 5 D. 3
Hướng dẫn giải
Chọn A.
(1). H2S+ SO2 → Sinh ra S (là phản ứng oxi hóa – khử)
(2). Ag + O3 → Sinh ra O2 (là phản ứng oxi hóa – khử)
(3). Na2SO3 + H2SO4 loãng → Sinh ra SO2 (không phải oxi hóa – khử)
(4) SiO2+ Mg → Sinh ra Si (là phản ứng oxi hóa – khử)
(5). SiO2 + HF → (không phải oxi hóa – khử)
(6). Al2O3 + NaOH → (không phải oxi hóa – khử)
(7). H2O2 + Ag2O → Sinh ra O2 (là phản ứng oxi hóa – khử)
(8). Ca3P2 + H2O → (không phải oxi hóa – khử)

 4Al + 3O2↑
4Al + 3O2↑