C4H10 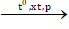 C3H6 + CH4 - Cân bằng phương trình hoá học
C3H6 + CH4 - Cân bằng phương trình hoá học
Phản ứng hoá học:
C4H10 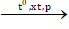
Điều kiện phản ứng
- Điều kiện nhiệt độ, áp suất và xúc tác thích hợp.
Cách thực hiện phản ứng
- Dưới tác dụng của nhiệt và chất xúc tác thích hợp các ankan bị bẻ gẫy các liên kết C – C tạo thành các phân tử nhỏ hơn.
Hiện tượng nhận biết phản ứng
- Sản phẩm thu được sau phản ứng làm mất màu dung dịch brom ở điều kiện thường.
Bạn có biết
- Phản ứng trên gọi là phản ứng cracking (bẻ gãy mạch cacbon).
- Sản phẩm thu được sau phản ứng ngoài C3H6 và CH4 còn có thể có C2H6, C2H4, C4H8, H2.
- Nếu hiệu suất phản ứng cracking là 100% không có quá trình thứ cấp thì tổng số mol sản phẩm tăng gấp đôi so với các chất tham gia nên khối lượng phân tử trung bình giảm đi một nửa.
- Số mol ankan sau phản ứng luôn bằng số mol ankan ban đầu dù quá trình cracking có nhiều giai đoạn.
- Dù phản ứng xảy ra theo hướng nào thì phản ứng không làm thay đổi khối lượng hỗn hợp: mtrước phản ứng = msau phản ứng.
- Phản ứng luôn làm tăng số mol khí: nsau > ntrước.

Ví dụ minh họa
Ví dụ 1: Crackinh hoàn toàn 11,2 lít (đktc) một ankan A thu được 22,4 lít (đktc) hỗn hợp khí B có tỉ khối đối với không khí bằng 1. Tên gọi của A là:
A. 2-metylbutan
B. butan
C. Neopentan
D. Pentan
Hướng dẫn:
Áp dụng định luật BTKL: nA.MA = nB.MB → MA = 1.29/0,5 = 58
→ CTPT của A là: C4H10.
Đáp án B.
Ví dụ 2: Crackinh m gam C4H10 thu được hỗn hợp X gồm CH4, C2H6, C2H4, C3H6, C4H8, C4H10 và H2. Đem đốt cháy hết toàn bộ hỗn hợp X thu được 17,6 gam CO2 và 9 gam H2O. Vậy giá trị của m là
A. 2,6
B. 5,8
C. 11,6
D. 23,2
Hướng dẫn:
mC4H10 = mC + mH = 0,4.12 + 0,5.2 = 5,8 g
Đáp án B.
Ví dụ 3: Crackinh 35 mol butan thu được hỗn hợp A gồm H2, CH4, C2H4, C2H6, C3H6, C4H8 và một phần butan chưa bị craking. Giả sử chỉ có các phản ứng tạo ra các sản phẩm trên. Nếu đốt cháy hoàn toàn A thì thu được x mol CO2. Giá trị của x là
A. 140
B. 70
C. 80
D. 40
Hướng dẫn:
Đốt cháy hỗn hợp A cũng như đốt cháy butan.
Ta có pt đốt cháy:
C4H10 + 13/2 O2 → 4CO2 + 5H2O
Theo pt: nCO2 = 4nC4H10 = 4.35 = 140 mol
Đáp án A.

