CH3-CH=CH2 + H2 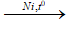 CH3–CH2–CH3 - Cân bằng phương trình hoá học
CH3–CH2–CH3 - Cân bằng phương trình hoá học
Phản ứng hoá học:
CH3-CH=CH2 + H2 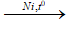
Điều kiện phản ứng
- Đun nóng, xúc tác niken (hoặc platin hoặc palađi).
Cách thực hiện phản ứng
- Đun nóng hỗn hợp propilen và H2 với xúc tác niken, propilen kết hợp với H2 thành propan (C3H8).
Hiện tượng nhận biết phản ứng
- Sản phẩm sinh ra không làm mất màu dung dịch brom.
Bạn có biết
- Phản ứng trên gọi là phản ứng cộng.
- Tương tự propen, các anken khác cũng tác dụng với H2 với xúc tác niken thành ankan tương ứng.
- Tỉ lệ phản ứng luôn là 1:1
- Khối lượng trước và sau phản ứng luôn bằng nhau
- Số mol sau phản ứng luôn giảm → Số mol H2 phản ứng = nđ - ns

Ví dụ minh họa
Ví dụ 1: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol propen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với H2 là 16. Tính số mol H2 phản ứng?
A. 0,15 mol
B. 0,2 mol
C. 0,25 mol
D. 0,3 mol
Hướng dẫn:
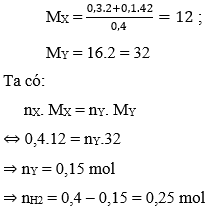
Đáp án C.
Ví dụ 2: Hỗn hợp khí X gồm H2 và C3H6 có tỉ khối so với H2 là 5,5. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 7,33. Hiệu suất của phản ứng hiđro hoá là:
A. 25%
B. 20%
C. 50%
D. 40%
Hướng dẫn
Giả sử trong 1 mol X có x mol H2 và y mol C3H6
⇒ x + y = 1 mol;
mhh = 2x + 42y = 5,5.4.1 = 22
⇒ x = y = 0,5 mol.
Do phản ứng trong bình kín nên bảo toàn khối lượng
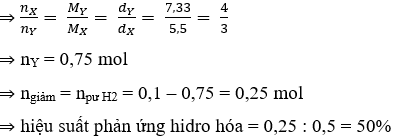
Đáp án D.
Ví dụ 3: Hỗn hợp X gồm H2, C2H4 và C3H6 có tỉ khối so với H2 là 9,25. Cho 22,4 lít X (đktc) vào bình kín có sẵn một ít bột Ni. Đun nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 10. Tổng số mol H2 đã phản ứng là
A. 0,070 mol
B. 0,015 mol
C. 0,075 mol
D. 0,050 mol
Hướng dẫn
mX = 18,5.1 = 18,5 g;
nY = 18,5/20 = 0,925 mol
⇒ nH2 pư = 1 – 0,925 = 0,075 mol
Đáp án C.

