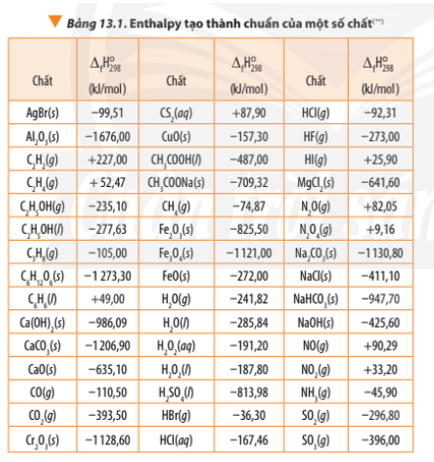
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene
Giải Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Haylamdo biên soạn và sưu tầm lời giải Bài 2 trang 92 Hóa học 10 trong Bài 14: Tính biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo, lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập Hóa học 10.
Bài 2 trang 92 Hóa học 10: Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Lời giải:
C6H6(l) + O2(g) 6CO2(g) + 3H2O(l)
∆ r = 6.∆ f(CO2) + 3. ∆ f(H2O) - ∆ f(C6H6) - ∆ f(O2)
∆ r = 6.(-393,50) + 3.(-285,84) – (+49,00) - .0
∆ r = -3267,52 kJ
1,0 gam C6H6(l) ứng với mol C6H6(l)
Đốt cháy 1 mol C6H6(l) tỏa ra 3267,52 kJ nhiệt lượng
⇒ Đốt cháy mol C6H6(l) tỏa ra là .3267,52 = 41,89 kJ nhiệt lượng
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-285,84) – (-105,00) - 5.0
∆ r = -2218,86 kJ
1,0 gam C3H8(g) ứng với mol C3H8(g)
Đốt cháy 1 mol C3H8(g) tỏa ra 2218,86 kJ nhiệt lượng
⇒ Đốt cháy mol C3H8(g) tỏa ra là .2218,86 = 50,43 kJ nhiệt lượng
Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) nhiều hơn khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).