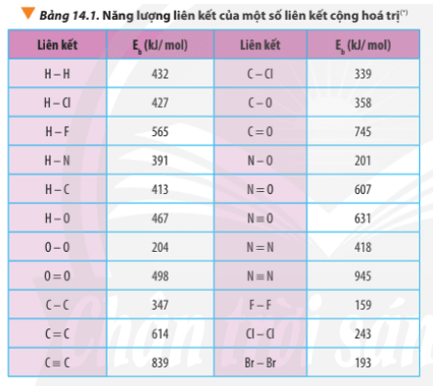
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy
Giải Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Haylamdo biên soạn và sưu tầm lời giải Vận dụng trang 90 Hóa học 10 trong Bài 14: Tính biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo, lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập Hóa học 10.
Vận dụng trang 90 Hóa học 10: Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) 2H2O(g) (1)
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)
Lời giải:
2H2(g) + O2(g) 2H2O(g) (1)
∆ r(1) = 2.Eb(H2) + Eb(O2) – 2.Eb(H2O)
∆ r(1) = 2.Eb(H-H) + Eb(O=O) – 2.2.Eb(O-H)
∆ r(1) = 2.432 + 498 – 2.2.467 = -506 kJ
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
∆ r(2) = Eb(C7H16) + 11.Eb(O2) – 7.Eb(CO2) – 8.Eb(H2O)
∆ r(2) = 6.Eb(C-C) + 16Eb(C-H) + 11.Eb(O=O) – 7.2.Eb(C=O) – 8.2.Eb(O-H)
∆ r(2) = 6.347 + 16.413 + 11.498 – 7.2.745 – 8.2.467 = -3734 kJ
Ta thấy: ∆ r(2) < ∆ r(1) ⇒ Phản ứng (2) xảy ra thuận lợi hơn phản ứng (1)
⇒ C7H16 là nhiên liệu hiệu quả hơn cho tên lửa.