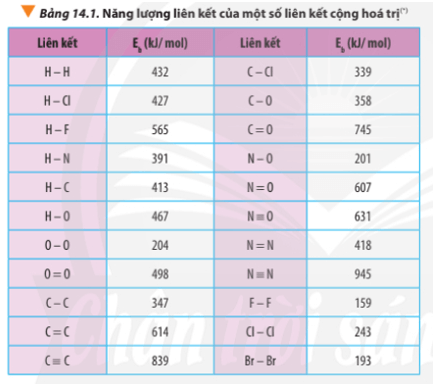
Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng
Giải Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Haylamdo biên soạn và sưu tầm lời giải Câu hỏi 3 trang 89 Hóa học 10 trong Bài 14: Tính biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo, lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập Hóa học 10.
Câu hỏi 3 trang 89 Hóa học 10: Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) 2NO(g)
Lời giải:
N2(g) + O2(g) 2NO(g)
∆ r = Eb(N2) + Eb(O2) – 2Eb(NO)
∆ r = Eb(N≡N) + Eb(O=O) – 2Eb(N=O)
∆ r = 945 + 498 – 2.607 = 229 kJ
Ta thấy để phá vỡ 1 liên kết N≡N và 1 liên kết O=O để hình thành 2 liên kết N-O cần cung cấp nhiệt lượng lớn (229 kJ).
⇒ Cần thực hiện ở nhiệt độ cao hoặc có tia lửa điện thì phản ứng mới xảy ra.