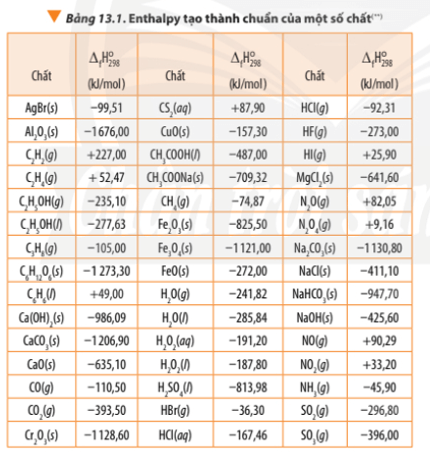
Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm
Giải Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Haylamdo biên soạn và sưu tầm lời giải Bài 3 trang 93 Hóa học 10 trong Bài 14: Tính biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo, lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập Hóa học 10.
Bài 3 trang 93 Hóa học 10: Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị ∆ r đối với phản ứng.
Lời giải:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
∆ r = 2.∆ f(Fe) + ∆ f(Al2O3) – 2. ∆ f(Al) - ∆ f(Fe2O3)
∆ r = 2.0 + (-1676,00) – 2.0 – (-825,5)
∆ r = -850,5 kJ < 0
⇒ Phản ứng nhiệt nhôm sinh ra một lượng nhiệt rất lớn.