Lý thuyết Hóa học 12 Bài 18: Cấu tạo và liên kết trong tinh thể kim loại - Kết nối tri thức
Haylamdo biên soạn tóm tắt lý thuyết Hóa 12 Bài 18: Cấu tạo và liên kết trong tinh thể kim loại sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa 12 Bài 18: Cấu tạo và liên kết trong tinh thể kim loại - Kết nối tri thức
I. ĐẶC ĐIỂM CẤU TẠO CỦA NGUYÊN TỬ KIM LOẠI
Trong cùng một chu kì, so với các nguyên tử nguyên tố phi kim, nguyên tử kim loại có điện tích hạt nhân nhỏ hơn và bán kính lớn hơn nên dễ nhường electron hoá trị hơn và có độ âm điện nhỏ hơn.
II. TINH THỂ KIM LOẠI
1. Tinh thể kim loại
- Ở nhiệt độ phòng, các đơn chất kim loại ở thể rắn và có cấu tạo tinh thể (trừ thuỷ ngân ở thể lỏng).
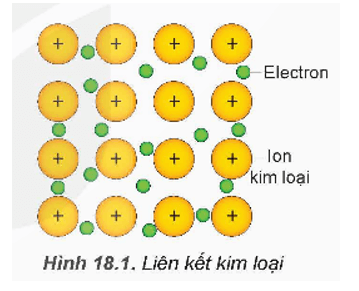
- Trong tinh thể kim loại, các ion dương kim loại nằm ở các nút mạng tinh thể và các electron hoá trị chuyển động tự do xung quanh.
- Mở rộng:
|
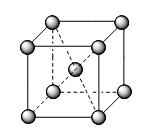
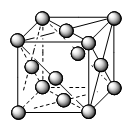
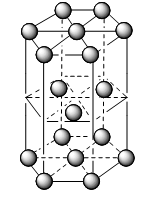
Các kiểu mạng tinh thể phổ biến của kim loại |
|||
|
Kiểu mạng tinh thể |
Mạng lập phương tâm khối |
Mạng lập phương tâm mặt |
Mạng lục phương chặt khít |
|
Cấu trúc |
|
|
|
|
Độ đặc khít (%) |
68 |
74 |
74 |
|
Số phố trí |
8 |
12 |
12 |
|
Ví dụ |
Li, Na, K, Ba… |
Ca, Sr, Cu… |
Be, Mg, … |
2. Liên kết kim loại
Trong tinh thể kim loại, liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron hoá trị tự do với các ion dương kim loại ở các nút mạng.