Lý thuyết Hóa học 12 Bài 28: Sơ lược về phức chất - Kết nối tri thức
Haylamdo biên soạn tóm tắt lý thuyết Hóa 12 Bài 28: Sơ lược về phức chất sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa 12 Bài 28: Sơ lược về phức chất - Kết nối tri thức
I. Một số khái niệm cơ bản về phức chất
- Phức chất là hợp chất có chứa nguyên tử trung tâm (thường được kí hiệu là M) và các phối tử (thường được kí hiệu là L).
Trong đó:
+ Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại liên kết với các phối tử. + Phối tử là anion hoặc phân tử.
+ Phức chất có thể mang điện tích hoặc không mang điện tích.
+ Trong công thức phức chất, nguyên tử trung tâm M và các phối tử L thường được đặt trong móc vuông.
- Ví dụ 1: Phức chất [Co(NH3)6]3+ có điện tích là +3, nguyên tử trung tâm là Co3+ và phối tử là NH3.
- Ví dụ 2: Phức chất [Zn(OH)4]2- có điện tích là -2, nguyên tử trung tâm là Zn2+ và phối tử là OH-.
Chú ý:
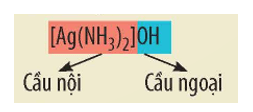
+ Trong công thức của phức chất, cầu nội được đặt trong móc vuông. Cầu nội của phức chất gồm nguyên tử trung tâm M và các phối tử L. Khi cầu nội mang điện tích, phức chất thường chứa ion cầu ngoại, các ion này trung hòa điện tích với ion cầu nội
Ví dụ:
+ Trong nhiều trường hợp, người ta chỉ quan tâm đến cầu nội do nó quyết định tính chất của phức chất.
Ví dụ: Trong dung dịch thuốc thử Tollens, phức [Ag(NH3)2]OH phân li như sau:
[Ag(NH3)2]OH [Ag(NH3)2]+ + OH-
Cation cầu nội [Ag(NH3)2]+ quyết định tính chất của thuốc thử Tollens.
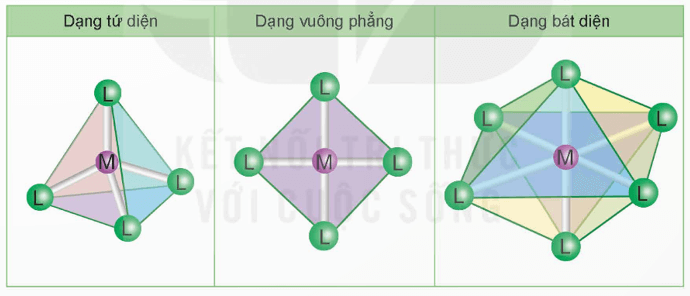
II. Một số dạng hình học của phức chất
Trong phức chất [MLn] (điện tích đã dược lược bỏ), các phối tử L sắp xếp một cách xác định xung quanh nguyên tử trung tâm M tạo ra các dạng hình học khác nhau, phổ biến là dạng tứ diện, vuông phẳng và bát diện.
Chú ý: Nét màu xanh nối các phối tử L trong phức chất để chỉ rõ dạng hình học của phức chất, nét màu trắng chỉ liên kết giữa M và L.
III. Liên kết trong phức chất
1. Liên kết giữa nguyên tử trung tâm và phối tử
- Liên kết hóa học giữa nguyên tử trung tâm M và phối tử L trong phức chất là liên kết cho – nhận, được hình thành nhờ sự cho cặp electron chưa liên kết của phối tử vào orbital trống của nguyên tử trung tâm.
- Ví dụ:
+ Liên kết trong phức chất [Co(OH)4]2- được hình thành do phối tử OH- cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Co3+.
+ Liên kết trong phức chất [Zn(NH3)6]3+ được hình thành do phối tử NH3 cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Zn2+.
2. Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp
Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hóa trị kiểu cho- nhận, hình thành phức chất aqua. Hầu hết các phức chất aqua có dạng hình học bát diện ([M(H2O)6]n+).