Lý thuyết Hóa học 12 Bài 19: Tính chất vật lí và tính chất hoá học của kim loại - Kết nối tri thức
Haylamdo biên soạn tóm tắt lý thuyết Hóa 12 Bài 19: Tính chất vật lí và tính chất hoá học của kim loại sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa 12 Bài 19: Tính chất vật lí và tính chất hoá học của kim loại - Kết nối tri thức
I. TÍNH CHẤT VẬT LÍ
Ở điều kiện thường, các kim loại đều có tính dẻo, dẫn diện, dẫn nhiệt và có ánh kim.
1. Tính dẻo
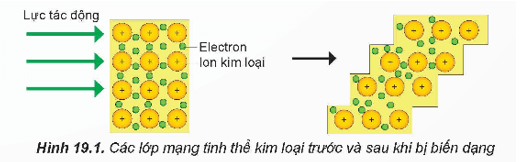
- Kim loại có tính dẻo: dễ rèn, dễ rát mỏng và dễ kéo sợi. Tính chất này khác với phi kim và các hợp chất ion.
- Khi thanh kim loại chịu được lực tác động (rèn, cán, kéo….) các ion dương kim loại trong mạng tinh thể kim loại có thể trượt lên nhau mà không tách rời nhau. Đó là do các electron tự do trong mạng tinh thể kim loại chuyển động, liên kết các ion dương kim loại với nhau.
- Những kim loại có tính dẻo cao là Au, Ag, Al, Cu, Sn….. Người ta có thể dát được những lá vàng mỏng tới khoảng 8nm.
- Nhờ có tính dẻo mà kim loại có thể được uốn cong, ép khuôn thành nhiều hình dạng hay kích thước khác nhau.
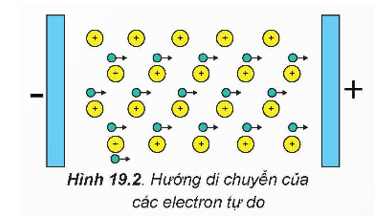
2. Tính dẫn điện
- Tất cả các kim loại đều có tính dẫn điện. Khi một hiệu điện thế được áp vào thanh kim loại, các electron tự do trong mạng tinh thể sẽ di chuyển từ phía cực âm về phía cực dương. Hệ quả là thanh kim loại trở thành vật dẫn điện.
- Bạc (Ag) là kim loại dẫn điện tốt nhất, tiếp sau bạc là đồng (Cu), vàng (Au) và nhôm (Al),….Tuy nhiên, nhôm và đồng thường được sử dụng làm dây dẫn điện hơn.
3. Tính dẫn nhiệt
- Tính dẫn nhiệt của các kim loại cũng được giải thích bằng sự có mặt của các electron tự do trong mạng tinh thể. Khi đốt nóng một đầu của thanh kim loại thì động năng của electron trong vùng đó tăng lên. Các electron này truyền động năng của chúng cho các ion dương ở các nút mạng và các electron khác trong toàn thanh kim loại thông qua va chạm, làm cho nhiệt được lan truyền trong toàn bộ thanh kim loại.
- Các kim loại dẫn điện tốt thường dẫn nhiệt tốt. Do tính dẫn nhiệt tốt các kim loại hoặc hợp kim được sử dụng làm các dụng cụ nấu ăn như xoong, nồi, chảo….
4. Tính ánh kim
- Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được. Do đó, kim loại có vẻ sáng lấp lánh, gọi là “ánh kim”.
- Trên thực thế, khi nhìn vào nhiều kim loại không thấy ánh kim vì chúng thường bị bao phủ bởi một lớp oxide, ví dụ như sắt thường có gỉ sắt, nhôm bị phủ bởi lớp aluminium oxide,…
5. Một số tính chất vật lí khác của kim loại
a) Khối lượng riêng
Khối lượng riêng của các kim loại rất khác nhau. Kim loại nhẹ nhất là lithium (D = 0,534g/cm3), kim loại nặng nhất là osmium (D = 22,6 g/cm3). Kim loại có D < 5 g/cm3 được gọi là kim loại nhẹ, những kim loại có D ≥ 5 g/cm3, được gọi là kim loại nặng.
b) Nhiệt độ nóng chảy
Nhiệt độ nóng chảy của các kim loại biến đổi trong khoảng rộng: Có kim loại nóng chảy ở nhiệt độ rất cao, nhưng tungsten (vonfram, W) nóng chảy ở 3410oC; kim loại duy nhất ở trạng thái lỏng trong điều kiện thường là thuỷ ngân (nhiệt độ nóng chảy là -39oC)
c) Tính cứng
Các kim loại có độ cứng rất khác nhau. Kim loại cứng nhất là chromium, có thể cắt được kính, các kim loại mềm nhất là kim loại kiềm như potassium, rubidium, sodium và caesium, chúng có thể được cắt dễ dàng bằng dao.
II. Tính chất hoá học
Các nguyên tử kim loại dễ nhường electron hoá trị:
M → Mn+ + ne
Trong đó: M là kí hiệu của kim loại.
Như vậy, tính chất hoá học chung của kim loại là tính khử.
1. Tác dụng với phi kim
Hầu hết các kim loại điều phản ứng với các phi kim điển hình
a) Tác dụng với oxygen
Hầu hết các kim loại (trừ vàng, bạc, platium,…) đều tác dụng với oxygen tạo thành oxide.
Ví dụ:
4Al(s) + 3O2(g) 2Al2O3(s)
2Mg(s) + O2(g) 2MgO(s)
b) Tác dụng với chlorine
Hầu hết các kim loại đều tác dụng với khí chlorine khi đun nóng, thu được muối chloride tương ứng
Ví dụ:
2Fe(s) + 3Cl2(g) 2FeCl3(s)
Cu(s) + Cl2(g) CuCl2(s)
c) Tác dụng với lưu huỳnh (sulfur)
Nhiều kim loại có thể khử lưu huỳnh khi đun nóng (trừ thuỷ ngân phản ứng ngay ở nhiệt độ thường)
Ví dụ:
Fe (s) + S(s) FeS(s)
Hg(l) + S(s) HgS(s)
2. Tác dụng với nước
- Hầu hết các kim loại nhóm IA, IIA có tính khử mạnh, tác dụng với nước ở nhiệt độ thường giải phóng khí H2
Ví dụ:
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
- Những kim loại có thế điện cực chuẩn nhỏ hơn -0,414V có thể đẩy được hydrogen ra khỏi nước.
3. Tác dụng với acid
a) Với dung dịch HCl, H2SO4 loãng
Ở điều kiện chuẩn, những kim loại có < 0 có thể tác dụng với các dung dịch acid (như HCl, H2SO4) tạo thành H2.
Ví dụ:
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g)
b) Với dung dịch H2SO4 đặc
Hầu hết kim loại (trừ Pt, Au ) khử được (trong H2SO4 đặc) xuống số oxi hoá thấp hơn.
Ví dụ:
Cu(s) + 2H2SO4 (đặc) CuSO4(aq) + SO2(g) + 2H2O(l)
Chú ý: HNO3 đặc, nguội và H2SO4 đặc nguội làm thụ động hoá Al, Fe, Cr,…
c) Tác dụng với muối
Kim loại hoạt động mạnh hơn có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối của nó
Ví dụ:
Cu(s) + 2AgNO3(aq) → Cu(NO3)2(aq) + 2Ag