CH3-CH=CH–CH3 + H2 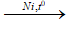 CH3–CH2–CH2–CH3 - Cân bằng phương trình hoá học
CH3–CH2–CH2–CH3 - Cân bằng phương trình hoá học
Phản ứng hoá học:
CH3-CH=CH–CH3 + H2 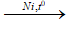
Điều kiện phản ứng
- Đun nóng, xúc tác niken (hoặc platin hoặc palađi).
Cách thực hiện phản ứng
- Đun nóng hỗn hợp but-2-en và H2 với xúc tác niken, but -2-en kết hợp với H2 thành butan (C4H10).
Hiện tượng nhận biết phản ứng
- Sản phẩm sinh ra không làm mất màu dung dịch brom.
Bạn có biết
- Phản ứng trên gọi là phản ứng cộng.
- Tỉ lệ phản ứng luôn là 1:1
- Khối lượng trước và sau phản ứng luôn bằng nhau
- Số mol sau phản ứng luôn giảm → Số mol H2 phản ứng = nđ - ns

Ví dụ minh họa
Ví dụ 1: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol but – 2 – en. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với H2 là 16. Tính số mol H2 phản ứng?
A. 0,15 mol
B. 0,2 mol
C. 0,25 mol
D. 0,3 mol
Hướng dẫn:
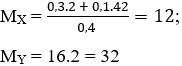
Ta có:
nX. MX = nY. MY
⇔ 0,4.12 = nY.32
⇒ nY = 0,15 mol
⇒ nH2 = 0,4 – 0,15 = 0,25 mol
Đáp án C.
Ví dụ 2: Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom ; tỉ khối của Y so với H2 bằng 13. Công thức cấu tạo của anken là
A. CH3CH=CHCH3.
B. CH2=CHCH2CH3.
C. CH2=C(CH3)2.
D. CH2=CH2.
Hướng dẫn
Giả sử ban đầu hỗn hợp X có tổng số mol là 1(mol).
Gọi x, y lần lượt là số mol của Hiđro và Anken (CnH2n) → x + y = 1
Vì dX/H2 = 9,1
→ MX = 18,2
→ 2x + 14nyx + y = 18,2
→ 2x + 14ny = 18,2
→ mX = mY = 18,2(g)
dY/H2 = 13 → MY = 26
↔ mY.nY = 26
↔ nY = 0,7
Vì khí Y ko làm mất màu nước Brôm nên Anken phản ứng hết và nY = 0,7
→ nH2 pư = nX – nY = 1 − 0,7 = 0,3 = nCnH2n
→ nH2 bđ = 0,7 (mol)
→ 14n.0,3 + 2.0,7 = 18,2
↔ n = 4
→ CTPT C4H8
Vì anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất nên CTCT của Anken là: CH3−CH=CH−CH3
Đáp án A
Ví dụ 3: Cho H2 và 1 olefin có thể tích bằng nhau qua Niken đun nóng ta được hỗn hợp A. Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là
A. C2H4.
B. C3H6.
C. C4H8.
D. C5H10.
Hướng dẫn
nH2 = nanken = 1; H = 75%
⇒ nH2 pư = nCnH2n pư = nCnH2n+2 = 0,75
hh A gồm: 0,75 mol CnH2n+2; 0,25 mol H2 dư và 0,25 mol nCnH2n dư
⇒ nA = 1,25 mol
MA = [0.75.(14n + 2) + 0,25.2 + 0,25.14n]/1,25 = 23,2.2 ⇒ n = 4
⇒ C4H8
Đáp án C.

