C6H5OH + KOH → C6H5OK + H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
C6H5OH + KOH → C6H5OK + H2O
Điều kiện phản ứng
- Điều kiện thường.
Cách thực hiện phản ứng
- Nhỏ 2ml KOH đặc vào ống nghiệm chứa 1 ít phenol.
Hiện tượng nhận biết phản ứng
- Phenol hầu như không tan trong nước lạnh nhưng tan trong dung dịch NaOH.
Bạn có biết
- phản ứng trên chứng tỏ phenol có tính axit.

Ví dụ minh họa
Ví dụ 1:
KOH không phản ứng với chất nào sau đây?
A. CH3Br. B. C6H5OH. C. C2H5Cl. D. CH4.
Hướng dẫn giải
CH4 không phản ứng với KOH.
Đáp án D.
Ví dụ 2:
Khối lượng KOH có trong dung dịch cần dùng để phản ứng hoàn toàn với 0,1 mol phenol là
A. 5,6 gam. B. 0,56 gam. C. 11,2 gam. D. 1,12 gam.
Hướng dẫn giải
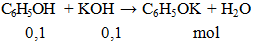
khối lượng KOH = 0,1.56 = 5,6 gam.
Đáp án A.
Ví dụ 3:
Cho 0,56g KOH hòa tan vào nước được dung dịch X. Lượng dung dịch X trên phản ứng vừa đủ với lượng phenol có số mol là
A. 0,1 mol. B. 1 mol. C. 0,01 mol. D. 0,2 mol.
Hướng dẫn giải
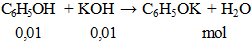
Đáp án C.

