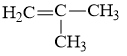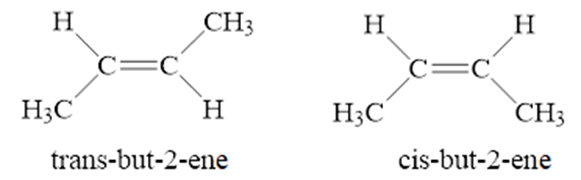Lý thuyết Hóa học 11 Kết nối tri thức Bài 16: Hydrocarbon không no
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 16: Hydrocarbon không no sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Kết nối tri thức Bài 16: Hydrocarbon không no
I. Khái niệm, đồng phân, danh pháp
1. Khái niệm và công thức chung của alkene, alkyne
Hydrocarbon không no là những hydrocarbon trong phân tử có chứa liên kết đôi, liên kết ba (gọi chung là liên kết bội) hoặc đồng thời cả liên kết đôi và liên kết ba.
Hydrocarbon không no |
Alkene |
Alkyne |
Khái niệm |
Alkene là các hydrocarbon không no, mạch hở, có chứa một liên kết đôi >C = C< trong phân tử |
Alkyne là các hydrocarbon không no, mạch hở có chứa một liên kết ba − C≡C – trong phân tử |
Công thức chung |
CnH2n (n ≥ 2) |
CnH2n - 2 (n ≥ 2) |
Ví dụ |
C2H4, C3H6, C4H8 …. |
C2H2, C3H4, C4H6 …. |
2. Đồng phân
a) Đồng phân cấu tạo
Alkene và alkyne có hai loại đồng phân cấu tạo là đồng phân vị trí liên kết bội (từ C4 trở lên) và đồng phân mạch carbon (từ C4 trở lên với alkene và từ C5 trở lên với alkyne).
Ví dụ: Alkene C4H8 có 3 đồng phân cấu tạo:
CH2 = CH – CH2 – CH3
CH3 – CH = CH – CH3
b) Đồng phân hình học
Trong phân tử alkene nếu mỗi nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử hoặc hai nhóm nguyên tử khác nhau thì sẽ có đồng phân hình học.
+ Nếu mạch chính nằm ở cùng một phía của liên kết đôi, gọi là đồng phân hình học dạng cis −.
+ Nếu mạch chính nằm ở hai phía khác nhau của liên kết đôi, gọi là đồng phân hình học dạng trans−.
Ví dụ: phân tử but – 2 − ene có hai đồng phân hình học dạng cis− và dạng trans−.
3. Danh pháp
Tên theo danh pháp thay thế của alkene và alkyne:
Phần nền - vị trí liên kết bội - ene hoặc yne
Lưu ý:
+ Chọn mạch carbon dài nhất, có nhiều nhánh nhất và có chứa liên kết bội làm mạch chính.
+ Đánh số sao cho nguyên tử carbon có liên kết bội (đôi hoặc ba) có chỉ số nhỏ nhất (đánh số mạch chính từ đầu gần liên kết bội).
+ Dùng chữ số (1, 2, 3,...) và gạch nối (-) để chì vị trí liên kết bội (nếu chỉ có một vị trí duy nhất của liên kết bội thì không cần).
+ Nếu alkene hoặc alkyne có nhánh thì cần thêm vị trí nhánh và tên nhánh trước tên của alkene và alkyne tương ứng với mạch chính.
II. Đặc điểm cấu tạo của ethylene và acetylene
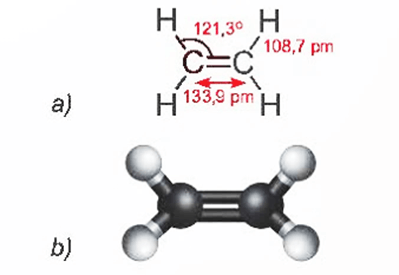
1. Ethylene
Phân tử ethylene (C2H4) có 2 nguyên tử carbon và 4 nguyên tử hydrogen đều nằm trên một mặt phẳng. Liên kết đôi C = C gồm 1 liên kết σ và 1 liên kết π.
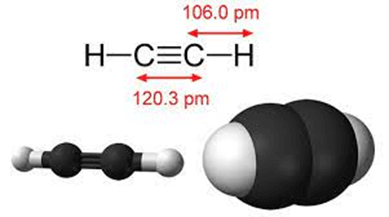
2. Acetylene
Phân tử acetylene (C2H2) có 2 nguyên tử carbon và 2 nguyên tử hydrogen nằm trên một đường thẳng, góc liên kết là 180o. Liên kết ba C ≡ C bao gồm một liên kết liên kết σ và hai liên kết π.
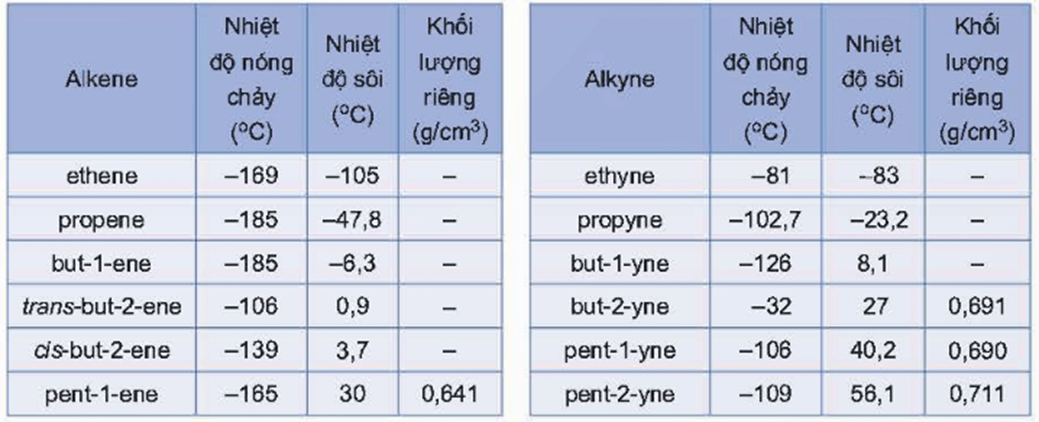
III. Tính chất vật lí
Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng của alkene, alkyne không khác nhiều với alkane tương ứng. Các alkene, alkyne là những hợp chất không có mùi và đều nhẹ hơn nước.
Ở nhiệt độ thường, phần lớn các alkene và alkyne từ C2 đến C4 ở trạng thái khí, từ C5 trở lên ở trạng thái lỏng hoặc trạng thái rắn. Chúng không tan hoặc rất ít tan trong nước, tan trong một số dung môi hữu cơ.
Tính chất vật lí của một số alkene, alkyne được thể hiện trong bảng sau:
IV. Tính chất hoá học của alkene, alkyne
Các liên kết ℼ ở liên kết đôi (alkene) và liên kết ba (alkyne) kém bền vững, dễ bị đứt ra để tạo thành các liên kết mới. Vì vậy, các liên kết bội là trung tâm gây ra các phản ứng đặc trưng của hydrocarbon không no: phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hoá.
1. Phản ứng cộng
a) Phản ứng cộng hydrogen
Hydrogen hoá alkene thu được alkane tương ứng. Phản ứng thường được thực hiện dưới áp suất cao, nhiệt độ cao và có mặt các chất xúc tác kim loại như platinum, nickel và palladium.
Ví dụ:
CH2 = CH2 + H2 CH3 – CH3
Hydrogen hoá alkyne, tuỳ vào điều kiện áp suất, nhiệt độ và xúc tác, có thể nhận được sản phẩm là alkene, alkane.
Ví dụ:
CH ≡ CH + H2 CH2 = CH2
CH ≡ CH + 2H2 CH3 – CH3
b) Phản ứng cộng halogen
Khi cho alkene hoặc alkyne phản ứng với dung dịch bromine, dung dịch sẽ bị mất màu.
Ví dụ:
CH2 = CH2 + Br2 → BrCH2 – CH2Br
CH ≡ CH + 2Br2 → Br2HC – CHBr2
c) Phản ứng cộng hydrogen halide
Phản ứng cộng hydrogen halide vào alkene và alkyne tạo thành halogenoalkane tương ứng.
CH2 = CH2 + HBr → CH3 – CH2Br
CH ≡ CH + HBr → CH2 = CHBr
CH ≡ CH + 2HBr → CH3 – CHBr2
d) Phản ứng cộng nước (hydrate hoá)
- Phản ứng cộng nước vào alkene hay còn gọi là hydrate hoá alkene tạo ra alcohol.
Phản ứng thường sử dụng xúc tác phosphoric acid hoặc sulfuric acid.
Ví dụ:
CH2 = CH2 + H2O CH3 – CH2OH
Phản ứng này được thực hiện ở quy mô công nghiệp để sản xuất ethanol.
- Phản ứng cộng một phân tử HOH vào alkyne diễn ra khi có mặt của xúc tác là muối Hg(II) trong H2SO4, tạo thành aldehyde hoặc ketone.
Ví dụ:
CH ≡ CH + H2O CH3 – CH = O
CH3C = CH + H2O CH3 – CO – CH3
Chú ý:
Phản ứng cộng acid, cộng nước vào alkyne cũng tuân theo quy tắc Markovnikov: Phản ứng cộng một tác nhân không đối xứng HX như HBr, HCl, HI, HOH, … vào liên kết bội, nguyên tử hydrogen sẽ ưu tiên cộng vào nguyên tử carbon có nhiều hydrogen hơn và X sẽ cộng vào nguyên tử carbon có ít hydrogen hơn.
2. Phản ứng trùng hợp của alkene
Phản ứng trùng hợp alkene là quá trình cộng hợp liên tiếp nhiều phân tử alkene giống nhau hoặc tương tự nhau (gọi là monomer) thành phân tử có phân tử khối lớn (gọi là polymer).
Ví dụ: Phản ứng trùng hợp ethylene tạo thành polyethylene (PE):
n được gọi là hệ số trùng hợp.
Phản ứng trùng hợp alkene có ứng dụng quan trọng để sản xuất vật liệu polymer.
3. Phản ứng của alk – 1 – yne với AgNO3 trong NH3
Các alk – 1 – yne có thể phản ứng với AgNO3/ NH3 tạo kết tủa.
Ví dụ:
CH ≡ CH + 2AgNO3 + 2NH3 → Ag – C ≡ C – Ag↓ + 2NH4NO3
Phản ứng này dùng để nhận biết các alkyne có liên kết ba ở đầu mạch.
4. Phản ứng oxi hoá
a) Phản ứng oxi hoá không hoàn toàn
Các alkene và alkyne có khả năng làm mất màu dung dịch thuốc tím, đây là phản ứng oxi hoá không hoàn toàn.
Ví dụ:
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
Phản ứng oxi hoá không hoàn toàn alkene được ứng dụng để sản xuất các dẫn xuất chứa oxygen của hydrocarbon trong công nghiệp.
b) Phản ứng cháy
Alkene và alkyne đều dễ cháy khi có mặt oxygen, phản ứng toả nhiều nhiệt. Tổng quát:
V. Điều chế
1. Alkene
Trong phòng thí nghiệm, ethylene được điều chế từ phản ứng dehydrate ethanol:
C2H5OH C2H4 + H2O
Trong công nghiệp, alkene từ C2 đến C4 được điều chế từ quá trình cracking alkane trong các nhà máy lọc dầu.
2. Alkyne
Acetylene được điều chế từ phản ứng giữa calcium carbide với nước:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Ngoài ra, acetylene còn được điều chế bằng cách nhiệt phân methane ở nhiệt độ 1500 oC, làm lạnh nhanh để tách acetylene ra khỏi hỗn hợp với hydrogen:
2CH4 C2H2 + 3H2
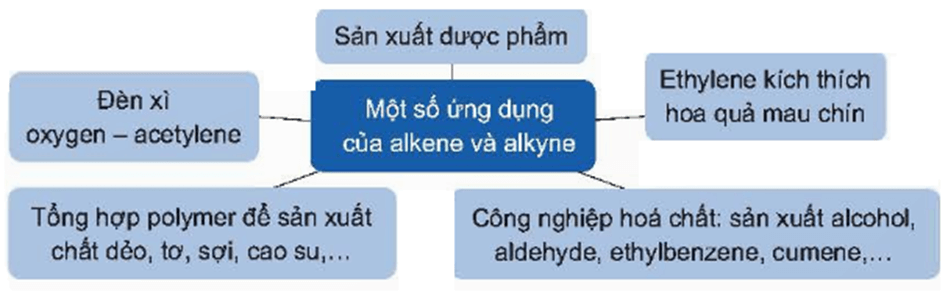
VI. Ứng dụng
Một số ứng dụng của alkene và alkyne được thể hiện trong sơ đồ sau: