Lý thuyết Hóa học 11 Kết nối tri thức Bài 25: Ôn tập chương 6
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 25: Ôn tập chương 6 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Kết nối tri thức Bài 25: Ôn tập chương 6
HỆ THỐNG KIẾN THỨC
I. Tính chất hoá học hợp chất carbonyl
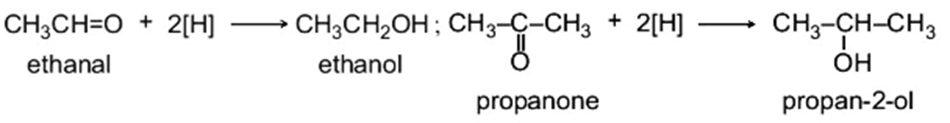
1. Phản ứng khử
Các hợp chất carbonyl bị khử bởi các tác nhân khử như NaBH4, LiAlH4, … (kí hiệu: [H]) tạo thành các alcohol tương ứng: aldehyde bị khử thành alcohol bậc I, ketone bị khử thành alcohol bậc II.
Ví dụ:
2. Phản ứng oxi hoá aldehyde
Aldehyde dễ bị oxi hoá bởi các tác nhân oxi hoá thông thường như: Br2/H2O, [Ag(NH3)2]OH, Cu(OH)2/OH- ….
a) Oxi hoá aldehyde bởi nước bromine
Aldehyde bị oxi hoá bởi nước bromine tạo thành carboxylic acid.
Ví dụ:
CH3CHO + Br2 + H2O → CH3COOH + 2HBr
b) Oxi hoá aldehyde bởi thuốc thử Tollens
Thuốc thử Tollens là phức chất của ion Ag+ với ammonia, có công thức [Ag(NH3)2]OH. Ion Ag+ trong thuốc thử Tollens đóng vai trò là chất oxi hoá:
RCHO + 2[Ag(NH3)2]OH RCOONH4 + 2Ag + 3NH3 + H2O
Phản ứng tạo thành lớp bạc sáng bóng bám vào bình phản ứng, vì vậy phản ứng này còn được gọi là phản ứng tráng bạc.
Ketone không bị oxi hoá bởi thuốc thử Tollens, vì vậy có thể dùng thuốc thử Tollens để phân biệt aldehyde với ketone và các hợp chất khác.
c) Oxi hoá aldehyde bằng copper(II) hydroxide
Aldehyde có thể bị oxi hoá bởi copper(II) hidroxide Cu(OH)2 trong môi trường kiềm khi đun nóng tạo thành kết tủa copper(I) oxide (Cu2O) màu đỏ gạch:
RCHO + 2Cu(OH)2 + NaOH RCOONa + Cu2O + 3H2O
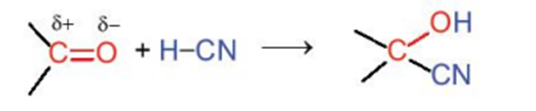
3. Phản ứng cộng
Hợp chất carbonyl có thể tham gia phản ứng cộng với HCN vào liên kết đôi C = O.
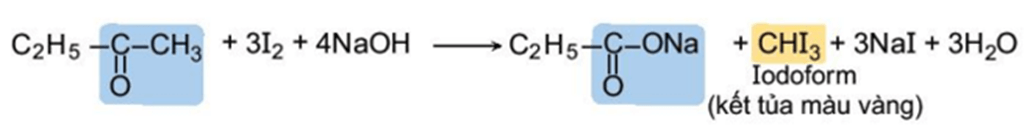
4. Phản ứng tạo iodoform
Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm.
Ví dụ:
Phản ứng tạo sản phẩm kết tủa iodoform nên phản ứng này được gọi là phản ứng iodoform và được dùng để nhận biết các aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl.
II. Tính chất hoá học carboxylic acid
1. Tính acid
Trong dung dịch nước, chỉ một phần nhỏ carboxylic acid phân li thành ion, vì vậy carboxylic acid là những acid yếu. Chúng thể hiện đầy đủ tính chất của acid.
Ví dụ:
2CH3COOH + Zn → (CH3COO)2Zn + H2
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
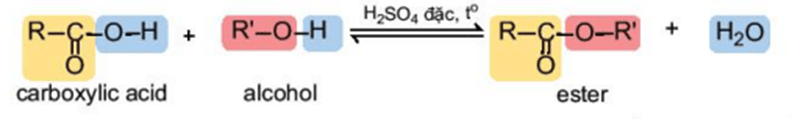
2. Phản ứng ester hoá
Carboxylic acid phản ứng với alcohol tạo thành ester và nước theo phản ứng:
Phản ứng giữa carboxylic acid và alcohol được gọi là phản ứng ester hoá. Phản ứng có đặc điểm là thuận nghịch và thường dùng sulfuric acid đặc làm xúc tác.