Lý thuyết Hóa học 11 Kết nối tri thức Bài 3: Ôn tập chương 1
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 3: Ôn tập chương 1 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Kết nối tri thức Bài 3: Ôn tập chương 1
HỆ THỐNG HOÁ KIẾN THỨC
1. Cân bằng hoá học
- Phân biệt phản ứng một chiều và phản ứng thuận nghịch:
Phản ứng một chiều |
Phản ứng thuận nghịch |
|
aA + bB → cC + dD Phản ứng chỉ xảy ra theo một chiều từ chất đầu tạo thành sản phẩm. |
aA + bB ⇌ cC + dD Trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau. |
- Cân bằng hoá học:
Trạng thái cân bằng |
vthuận = vnghịch; nồng độ các chất trong hệ phản ứng không đổi. |
Hằng số cân bằng |
Trong đó: [A]; [B]; [C]; [D] là nồng độ mol của các chất ở trạng thái cân bằng. Chất rắn không đưa vào biểu thức tính KC. KC chỉ phụ thuộc vào bản chất phản ứng và nhiệt độ. |
Các yếu tố ảnh hưởng đến cân bằng hoá học |
Nhiệt độ, nồng độ, áp suất |
Nguyên lí chuyển dịch cân bằng Le Chatelier |
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. |
2. Cân bằng trong dung dịch nước
|
Sự điện li - Quá trình phân li các chất trong nước tạo thành ion. - Chất điện li mạnh: acid mạnh, base mạnh, hầu hết các muối. - Chất điện li yếu: acid yếu, base yếu. - Chất không điện li: nước, saccharose, ethanol,… |
Thuyết acid – base của Bronsted – Lowry - Acid là chất cho proton. - Base là chất nhận proton. |
|
pH = -log[H+] hoặc [H+] = 10-pH 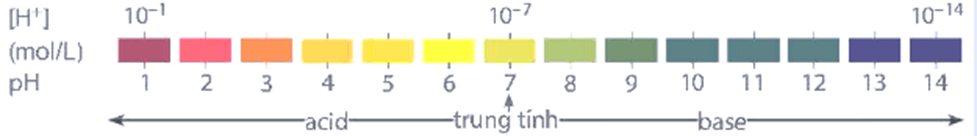
| |
Trong dung dịch nước, một số ion như Al3+, Fe3+ và phản ứng với nước tạo ra các dung dịch có môi trường acid/base. | |

