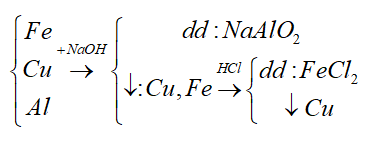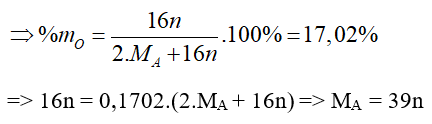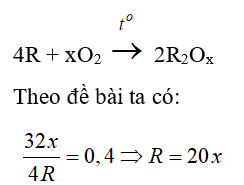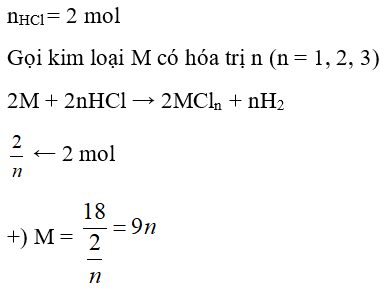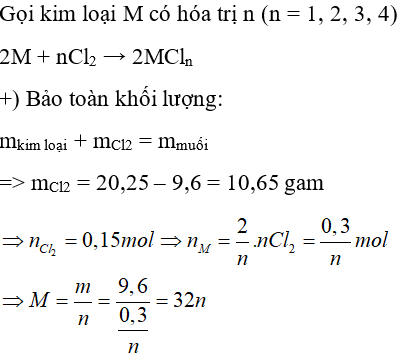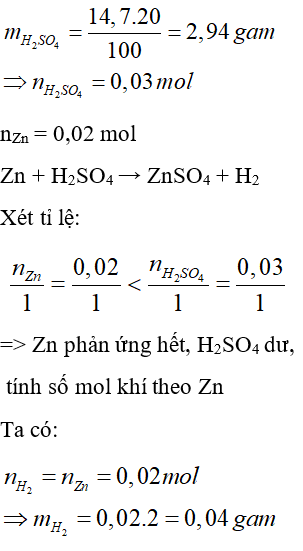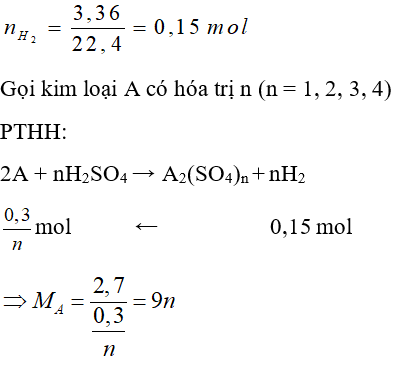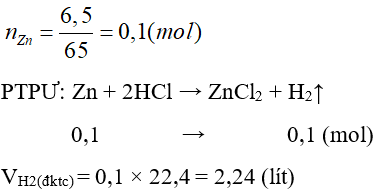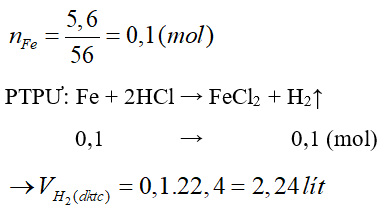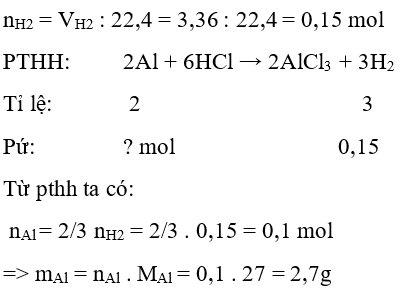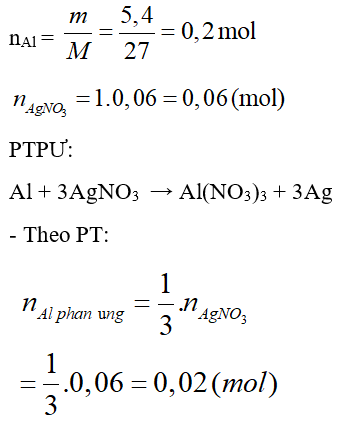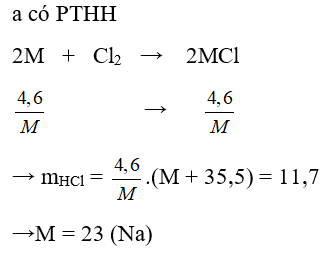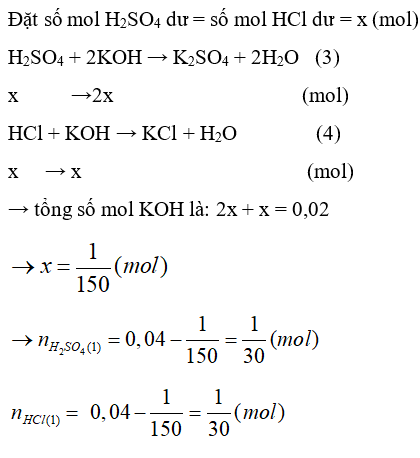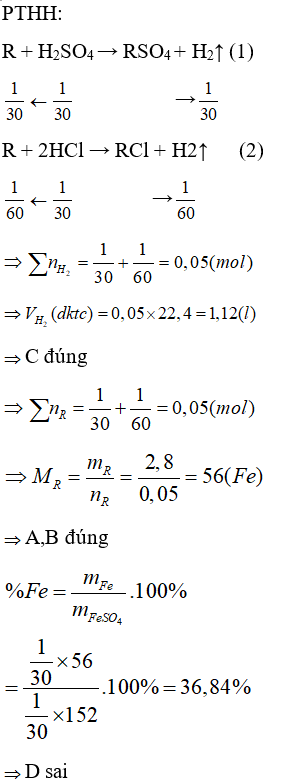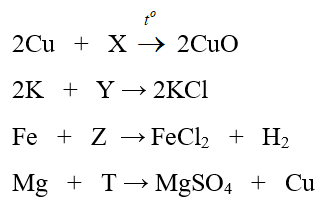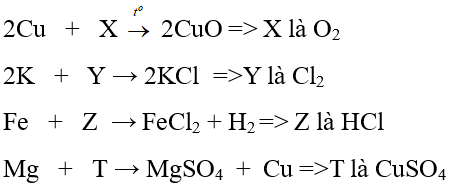Trắc nghiệm Hóa học 9 Bài 16 (có đáp án): Tính chất hóa học của kim loại (phần 2)
Trắc nghiệm Hóa học 9 Bài 16 (có đáp án): Tính chất hóa học của kim loại (phần 2)
Haylamdo biên soạn và sưu tầm câu hỏi trắc nghiệm Hóa học 9 Bài 16 (có đáp án): Tính chất hóa học của kim loại (phần 2) hay, chọn lọc sẽ giúp học sinh hệ thống lại kiến thức bài học và ôn luyện để đạt điểm cao trong bài thi môn Hóa học 9.

Câu 1: Tính chất hóa học chung của kim loại gồm:
A. Tác dụng với phi kim, tác dụng với axit.
B. Tác dụng với phi kim, tác dụng với bazơ, tác dụng với muối.
C. Tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
D. Tác dụng với oxit bazơ, tác dụng với axit.
Câu 2: Phương pháp nhiệt luyện dùng để điều chế
A. Các kim loại hoạt động mạnh như Ca, Na, Al
B. Các kim loại hoạt động yếu
C. Các kim loại hoạt động trung bình
D. Các kim loại hoạt động trung bình và yếu
Câu 3: Kim loại nhôm bị hòa tan bởi H2SO4 loãng, thu được muối sunfat và khí hiđro. Phản ứng mô tả hiện tượng trên là
A. 2Al + H2SO4 → Al2(SO4)3 + H2
B. 2Al + H2SO4 → Al2SO4 + H2
C. Al + 3H2SO4 → Al(SO4)3 + H2
D. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Câu 4: Ngâm một viên kẽm sạch trong dd CuSO4. Câu trả lời nào sau đây là đúng nhất cho hiện tượng quan sát được?
A. Không có hiện tượng nào xảy ra.
B. Một phần viên kẽm bị hòa tan, có một lớp màu đỏ bám ngoài viên kẽm và màu xanh lam của dung dịch nhạt dần.
C. Không có chất mới nào sinh ra, chỉ có một phần viên kẽm bị hòa tan.
D. Kim loại đồng màu đỏ bám ngoài viên kẽm, viên kẽm không bị hòa tan.
Câu 5: Thả một mảnh nhôm vào ống nghiệm chứa dung dịch CuSO4 . Xảy ra hiện tượng:
A. Không có dấu hiệu phản ứng
B. Có chất rắn màu trắng bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
C. Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
D. Có chất khí bay ra, dung dịch không đổi mà
Câu 6: Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy nào dưới đây?
A. FeCl3, MgO, Cu, Ca(OH)2
B. NaOH, CuO, Ag, Zn
C. Mg(OH)2, CaO, K2SO3, SO2
D. Al, Al2O3, Fe(OH)3, BaCl2
Câu 7: Chất nào sau đây không phản ứng với dung dịch HCl
A. Fe
B. Fe2O3
C. SO2
D. Mg(OH)2
Câu 8: Axit sunfuric loãng tác dụng được với dãy chất nào sau đây?
A. Zn, CO2, NaOH
B. Zn, Cu, CaO
C. Zn, H2O, SO3
D. Zn, NaOH, Na2O
Câu 9: Cho các kim loại Fe, Cu, Ag, Al, Mg. Trong các kết luận sau đây, kết luận nào sai ?
A. Kim loại tác dụng với dung dịch HCl, H2SO4 loãng: Cu, Ag
B. Kim loại tác dụng với dung dịch CuSO4 : Fe, Al, Mg
C. Kim loại không tác dụng với H2SO4 đặc nguội: Al, Fe
D. Kim loại không tan trong nước ở nhiệt độ thường: Tất cả các kim loại trên
Câu 10: Để tách riêng các chất khỏi hỗn hợp gồm Fe, Cu, Al cần phải dùng hóa chất nào sau đây là thích hợp nhất?
A. HCl và HNO3
B. NaOH và HCl
C. HCl và CuCl2
D. H2O và H2SO4
Câu 11: Cho phản ứng: Zn + CuSO4 → muối X + kim loại Y. X là
A. ZnSO4
B. CuSO4
C. Cu
D. Zn
Câu 12: Nhúng một thanh sắt vào dung dịch đồng (II) sunfat. Phản ứng hóa học xảy ra là:
A. Fe + CuSO4 -> FeSO4 + Cu.
B. Fe + Cu2SO4 -> FeSO4 + 2Cu.
C. 2Fe + 3CuSO4 -> Fe2(SO4)3 + 3Cu.
D. 2Fe + 3Cu2SO4 -> Fe2(SO4)3 + 6Cu.
Câu 13: Cho sơ đồ phản ứng sau: A + NaOH → NaAlO2 + H2O. A là chất nào trong số các chất sau:
A. Al
B. Al2O3
C. Al(OH)3
D. Cả B và C đều đúng
Câu 14: Một bạn học sinh đã đổ nhầm dung dịch sắt (II) sunfat vào lọ chứa sẵn dung dịch kẽm sunfat. Để thu được dung dịch chứa duy nhất muối kẽm sunfat, theo em dùng kim loại nào ?
A. Đồng
B. Sắt
C. Kẽm
D. Nhôm
Câu 15: Dung dịch muối ZnSO4 có lẫn một ít tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4 nêu trên là dễ dàng nhất?
A. Fe.
B. Zn.
C. Cu.
D. Mg.
Câu 16: Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng. Kim loại A là:
A. Cu
B. Zn
C. K
D. Na
Câu 17: Để oxi hóa hoàn toàn một kim loại R thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. R là kim loại nào sau đây ?
A. Fe
B. Al
C. Mg
D. Ca
Câu 18: Hòa tan 5,1g oxit của một kim loại hóa trị III bằng dung dịch HCl, số mol axit cần dùng là 0,3 mol. Công thức phân tử của oxit đó là :
A. Fe2O3
B. Al2O3
C. Cr2O3
D. FeO
Câu 19: Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây? (biết hóa trị của kim loại trong khoảng từ I đến III).
A. Ca
B. Mg
C. Al
D. Fe
Câu 20: Cho 17g oxit M2O3 tác dụng hết với dung dịch H2SO4 thu được 57g muối sunfat. Nguyên tử khối của M là:
A. 56
B. 52
C. 55
D. 27
Câu 21: Đốt cháy hoàn toàn 9,6 gam một kim loại M (chưa rõ hóa trị) trong bình chứa khí clo nguyên chất. Sau khi phản ứng kết thúc, để nguội thì thu được 20,25 gam muối clorua. Kim loại M là
A. Fe
B. Al
C. Cu
D. Zn
Câu 22: Cho 10,8 g một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4g muối. Kim loại M là:
A. Na
B. Fe
C. Al
D. Mg
Câu 23: Cho 1,3 gam kẽm phản ứng với 14,7 gam dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng khí thoát ra là:
A. 0,03 gam
B. 0,06 gam
C. 0,04 gam
D. 0,02 gam
Câu 24: Hòa tan 5,6 gam Fe bằng 250ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X có chứa chất tan T. Chất T có khả thể tác dụng với Na2CO3 tạo khí. Coi thể tích dung dịch thay đổi không đáng kể. Nồng độ mol của T là:
A. 0,2M.
B. 0,4M.
C. 0,6M.
D. 0,8M.
Câu 25: Cho 1,35g Al vào dung dịch chứa 7,3g HCl. Khối lượng muối nhôm tạo thành là
A. 6,675 g
B. 8,945 g
C. 2,43 g
D. 8,65 g
Câu 26: Hòa tan 2,7 gam kim loại A bằng dung dịch H2SO4 loãng dư. Sau phản ứng thu được 3,36 lít H2 (đktc). Kim loại A là:
A. Fe
B. Sn
C. Zn
D. Al
Câu 27: Cho 1,08 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
A. Niken
B. Canxi
C. Nhôm
D. Sắt
Câu 28: Clo hoá 33,6g một kim loại A ở nhiệt độ cao thu được 97,5g muối ACl3. A là kim loại:
A. Al
B. Cr
C. Au
D. Fe
Câu 29: Cho 6,5 gam Zn vào dung dịch HCl dư. Hỏi thể tích khí thu được từ phản ứng ở đktc là bao nhiêu? (cho Zn = 65)
A. 1,12 lít
B. 2,24 lít
C. 3,36 lít
D. 22,4 lít
Câu 30: Hòa tan hoàn toàn 5,6 gam Fe bằng dung dịch HCl, sau phản ứng thu được V lít H2 (đktc). Giá trị của V là:
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Câu 31: Cho lá nhôm vào dung dịch axit HCl có dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là :
A. 1,8 g
B. 2,7 g
C. 4,05 g
D. 5,4 g
Câu 32: Cho phản ứng hóa học: x… + H2SO4 -> FeSO4 + y…↑. Tổng (x + y) có thể là:
A. 1
B. 2
C. 3
D. 4
Câu 33: Cho phản ứng: Fe3O4 + 8HCl → xFeCl2 + yFeCl3 + 4H2O
Tỉ lệ x, y là:
A. 1:2
B. 2:1
C. 3:1
D. 1:1
Câu 34: Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
A. Al.
B. Fe.
C. Mg.
D. Cu.
Câu 35: Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
A. 0,1 mol.
B. 0,2 mol.
C. 0,3 mol.
D. 0,4 mol.
Câu 36: Ngâm một lá sắt có khối lượng 20g vào dung dịch bạc nitrat, sau một thời gian phản ứng nhấc lá kim loại ra làm khô cân nặng 23,2g. Lá kim loại sau phản ứng có:
A. 18,88g Fe và 4,32g Ag
B. 1,880g Fe và 4,32g Ag
C. 15,68g Fe và 4,32g Ag
D. 18,88g Fe và 3,42g Ag
Câu 37: Cho 5,4 (g) bột nhôm vào 60 (ml) dung dịch AgNO3 1M. Lắc kĩ để phản ứng xảy ra hoàn toàn. Sau phản ứng thu được m (g) chất rắn. Tính m?
A. 11,34g
B. 13,14g
C. 11,43g
D. 14,31g
Câu 38: Nhúng 1 thanh Al nặng 50 gam vào 400ml dung dịch CuSO4 0,5M. Sau một thời gian, lấy thanh Al ra cân nặng 51,38 gam. Khối lượng Cu đã giải phóng là:
A. 0,81g
B. 1,62g
C. 1,92g
D. 1,38g
Câu 39: Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch H2SO4 9,8% (loãng) vừa đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là:
A. Mg.
B. Fe.
C. Zn.
D. Cu.
Câu 40: Hoà tan 16,8g kim loại hoá trị II vào dung dịch HCl dư, sau phản ứng thu được 6,72 lít khí H2 (đktc). Kim loại đem hoà tan là:
A. Mg
B. Zn
C. Pb
D. Fe
Câu 41: Chọn câu đúng nhất khi nói đến tính chất hóa học của kim loại
A. Dãy gồm các kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thường) sẽ tạo thành các oxit bazơ tương ứng với nó.
B. Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Mg, Ca) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
C. Hầu hết tất cả các kim loại có thể phản ứng với dung dịch axit HCl hoặc H2SO4 loãng để giải phóng khí hiđro và sinh ra muối.
D. Ở nhiệt độ cao, các kim loại như Cu, Mg, Fe…phản ứng với lưu huỳnh tạo thành sản phẩm là muối sunfua tương ứng là CuS, MgS, FeS.
Câu 42: KL nào sau đây tác dụng với dd HCl loãng và tác dụng với khí Clo cho cùng loại muối clorua kim loại
A. Fe
B. Zn
C. Cu
D. Ag
Câu 43: Cho các phương trình hóa học sau:
(1) Cu + Fe(NO3)2 → Fe + Cu(NO3)2.
(2) Al + FeSO4 → Fe + Al2(SO4)3
(3) Mg + CuCl2 → MgCl2 + Cu
(4) Ba + Na2SO4 + 2H2O → BaSO4 + 2NaOH + H2.
Số phương trình hóa học viết chưa đúng là
A. 1
B. 2
C. 3
D. 4
Câu 44: Phản ứng sai là:
A. 3Fe + 2O2 → Fe3O4
B. 2Cu + O2 → 2CuO
C. 4Ag + O2 → 2Ag2O
D. 2Al + 3S → Al2S3
Câu 45: Cặp chất nào có tính chất hoá học tương tự nhau:
A. Mg và S
B. Ca và Oxi
C. Mg và Al
D. C và Na
Câu 46: Nung hỗn hợp gồm 5,6 gam sắt và 1,6 gam lưu huỳnh trong điều kiện không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 0,5M phản ứng vừa đủ với chất rắn A thu được hỗn hợp khí
B. Thể tích dung dịch HCl 0,5M đã dùng là
A. 100 ml.
B. 200 ml.
C. 300 ml.
D. 400 ml.
Câu 47: Hòa tan 25,8g hỗn hợp gồm bột Al và Al2O3 trong dung dịch HCl dư. Sau phản ứng người ta thu được 0,6g khí H2. Khối lượng muối AlCl3 thu được là :
A. 53,4g
B. 79,6g
C. 80,1g
D. 25,8g
Câu 48: Cho 4,6 gam một kim loại M hóa trị I phản ứng với khí Clo tạo thành 11,7g muối. M là kim loại nào sau đây?
A. Ag
B. Li
C. K
D. Na
Câu 49: Hòa tan 2,8 gam một kim loại R có hóa trị II bằng một hỗn hợp gồm 80 ml dung dịch H2SO4 0,5M và 200 ml dung dịch HCl 0,2M thu được dung dịch A và V lít khí H2(ở đktc). Để trung hòa dung dịch A thì cần 100 ml dung dịch KOH 0,2M. Phát biểu nào dưới đây về bài toán trên là chưa đúng?
A. Kim loại R không tan được trong nước ở điều kiện thường.
B. Kim loại R khi phản ứng với lưu huỳnh sẽ tạo ra chất rắn có màu đen.
C. Giá trị của V là 1,12.
D. Thành phần phần trăm về khối lượng của R (hóa trị II) trong hợp chất muối sunfat ứng với R là 28%.
Câu 50: Có các phản ứng sau:
a. HCl + (A) → MgCl2 + H2
b. AgNO3 + (B) → Cu(NO3)2 + Ag
c. S + (C) → K2S d. (D) + Cl2 → ZnCl2
(A), (B), (C), (D) lần lượt là:
A. KCl, MgO, CuO,ZnO
B. Zn, Mg, K,Cu
C. Mg, Cu, K,Zn
D. MgO, CuO, KCl,ZnO
Câu 51: Cho các phương trình phản ứng
A. O2, HCl, H2, CuO
B. O2, Cl2, HCl, CuSO4
C. O2, HCl, Cl2, SO3
D. O2, Cl2, H2, CuSO4
Câu 52: Đốt cháy hoàn toàn 1,35g nhôm trong oxi. .Khối lượng nhôm oxit tạo thành và khối lượng oxi đã tham gia phản ứng là:
A. 2,25g và 1,2g
B. 2,55g và 1,28g
C. 2,55 và 1,2g
D. 2,7 và 3,2 g
Câu 53: Đốt nhôm trong bình khí Clo . Sau phản ứng thấy khối lượng chất rắn trong bình tăng 7,1g . Khối lượng nhôm đã tham gia phản ứng là :
A. 2,7g
B. 1,8g
C. 4,1g
D. 5,4g