2C3H6 + 9O2 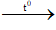 6CO2 + 6H2O - Cân bằng phương trình hoá học
6CO2 + 6H2O - Cân bằng phương trình hoá học
Phản ứng hoá học:
2C3H6 + 9O2 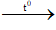
Điều kiện phản ứng
- Đốt cháy.
Cách thực hiện phản ứng
- Đốt cháy khí propilen trong không khí, sau phản ứng thu được khí CO2 và hơi nước.
Hiện tượng nhận biết phản ứng
- Sản phẩm sinh ra làm vần đục nước vôi trong.
Bạn có biết
- Phản ứng trên gọi là phản ứng oxi hóa hoàn toàn.
- Tương tự propilen, các anken khi bị đốt đều cháy và tỏa nhiều nhiệt.
- Khi đốt cháy anken, số mol H2O thu được sau phản ứng luôn bằng số mol CO2.

Ví dụ minh họa
Ví dụ 1: Đem đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp nhau thu được CO2 và nước có khối lượng hơn kém nhau 6,76 gam. CTPT của 2 anken đó là:
A. C2H4 và C3H6.
B. C3H6 và C4H8.
C. C4H8 và C5H10.
D. C5H10 và C6H12.
Hướng dẫn:
2CnH2n + 3nO2 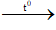
Gọi công thức chung của 2 anken là CnH2n
Ta có khối lượng chênh lệch giửa H2O và CO2 là
0,1.(44n - 18n) = 6,76
⇒ n = 2,6
⇒ C2H4 và C3H6
Đáp án A.
Ví dụ 2: Đốt cháy hoàn toàn khí C3H6 , dẫn toàn bộ sản phẩm cháy dẫn qua bình 1 đựng H2SO4 đặc, bình 2 đựng nước vôi trong dư thấy khối lượng bình 1 tăng 9g, bình 2 tăng m gam. Giá trị của m là:
A. 22 g
B. 44
C. 66 g
D. 11 g
Hướng dẫn:
2C3H6 + 9O2 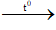
nH2O = nCO2 = 0,5 mol ⇒ mbình tăng 2 = mCO2 = 0,5.44 = 22 g
Đáp án D.
Ví dụ 3: Đốt cháy 1 mol khí propilen trong không khí, sau phản ứng thu được khí CO2 và hơi nước có tổng số mol là
B. 2.
B. 4.
C. 6.
D. 8.
Hướng dẫn:
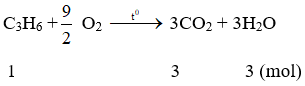
Đáp án C.

