500 câu hỏi trắc nghiệm Hóa học 11 (có đáp án) | Trắc nghiệm Hóa 11
Haylamdo biên soạn và sưu tầm trọn bộ 500 Câu hỏi trắc nghiệm Hóa học 11 sách mới Kết nối tri thức, Chân trời sáng tạo, Cánh diều có đáp án chi tiết, đầy đủ các mức độ nhận biết, thông hiểu, vận dụng sẽ giúp học sinh lớp 11 ôn tập trắc nghiệm Sinh 11 từ đó đạt điểm cao trong các bài thi Hóa học 11.
Trắc nghiệm Hóa học 11 (sách mới, có đáp án)
Lời giải bài tập Hóa học 11 hay, ngắn gọn:
Lưu trữ: Trắc nghiệm Hóa học 11 (sách cũ)
- Trắc nghiệm Sự điện li có đáp án năm 2023
- Trắc nghiệm Sự điện li có đáp án năm 2023 (phần 2)
- Trắc nghiệm Axit, bazơ, muối có đáp án năm 2023
- Trắc nghiệm Axit, bazơ, muối có đáp án năm 2023 (phần 2)
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit - bazơ có đáp án năm 2023
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit - bazơ có đáp án năm 2023 (phần 2)
- Trắc nghiệm Phản ứng trao đổi ion trong dung dịch các chất điện li có đáp án năm 2023
- Trắc nghiệm Phản ứng trao đổi ion trong dung dịch các chất điện li có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Axit, bazơ và muối, Phản ứng trao đổi ion trong dung dịch các chất điện li có đáp án năm 2023
- Trắc nghiệm Luyện tập: Axit, bazơ và muối, Phản ứng trao đổi ion trong dung dịch các chất điện li có đáp án năm 2023 (phần 2)
- Trắc nghiệm Bài thực hành 1: Tính axit, bazơ có đáp án năm 2023
- Trắc nghiệm Bài thực hành 1: Tính axit, bazơ có đáp án năm 2023 (phần 2)
- Đề kiểm tra 1 tiết Hóa học 11 Học kì 1 (Bài kiểm tra số 1) có đáp án năm 2023
- Trắc nghiệm Nitơ có đáp án năm 2023
- Trắc nghiệm Nitơ có đáp án năm 2023 (phần 2)
- Trắc nghiệm Amoniac và muối amoni có đáp án năm 2023
- Trắc nghiệm Amoniac và muối amoni có đáp án năm 2023 (phần 2)
- Trắc nghiệm Axit nitric và muối nitrat có đáp án năm 2023
- Trắc nghiệm Axit nitric và muối nitrat có đáp án năm 2023 (phần 2)
- Trắc nghiệm Photpho có đáp án năm 2023
- Trắc nghiệm Photpho có đáp án năm 2023 (phần 2)
- Trắc nghiệm Axit photphoric và muối photphat có đáp án năm 2023
- Trắc nghiệm Axit photphoric và muối photphat có đáp án năm 2023 (phần 2)
- Trắc nghiệm Phân bón hóa học có đáp án năm 2023
- Trắc nghiệm Phân bón hóa học có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Tính chất của nitơ, photpho có đáp án năm 2023
- Trắc nghiệm Luyện tập: Tính chất của nitơ, photpho có đáp án năm 2023 (phần 2)
- Trắc nghiệm Bài thực hành 2: Tính chất của một số hợp chất nitơ, photpho có đáp án năm 2023
- Trắc nghiệm Bài thực hành 2: Tính chất của một số hợp chất nitơ, photpho có đáp án năm 2023 (phần 2)
- Đề kiểm tra 1 tiết Hóa học 11 Học kì 1 (Bài kiểm tra số 2) có đáp án năm 2023
- Trắc nghiệm Cacbon có đáp án năm 2023
- Trắc nghiệm Cacbon có đáp án năm 2023 (phần 2)
- Trắc nghiệm Hợp chất của cacbon có đáp án năm 2023
- Trắc nghiệm Hợp chất của cacbon có đáp án năm 2023 (phần 2)
- Trắc nghiệm Silic và hợp chất của silic có đáp án năm 2023
- Trắc nghiệm Silic và hợp chất của silic có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Tính chất của cacbon, silic có đáp án năm 2023
- Trắc nghiệm Luyện tập: Tính chất của cacbon, silic có đáp án năm 2023 (phần 2)
- Trắc nghiệm Mở đầu về hóa học hữu cơ có đáp án năm 2023
- Trắc nghiệm Mở đầu về hóa học hữu cơ có đáp án năm 2023 (phần 2)
- Trắc nghiệm Công thức phân tử hợp chất hữu cơ có đáp án năm 2023
- Trắc nghiệm Công thức phân tử hợp chất hữu cơ có đáp án năm 2023 (phần 2)
- Trắc nghiệm Cấu trúc phân tử hợp chất hữu cơ có đáp án năm 2023
- Trắc nghiệm Cấu trúc phân tử hợp chất hữu cơ có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Hợp chất hữu cơ có đáp án năm 2023
- Trắc nghiệm Luyện tập: Hợp chất hữu cơ có đáp án năm 2023 (phần 2)
- Đề kiểm tra 1 tiết Hóa học 11 Học kì 2 (Bài kiểm tra số 1) có đáp án năm 2023
- Trắc nghiệm Ankan có đáp án năm 2023
- Trắc nghiệm Ankan có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Ankan có đáp án năm 2023
- Trắc nghiệm Luyện tập: Ankan có đáp án năm 2023 (phần 2)
- Trắc nghiệm Bài thực hành 3: Phân tích định tính nguyên tố metan có đáp án năm 2023
- Trắc nghiệm Bài thực hành 3: Phân tích định tính nguyên tố metan có đáp án năm 2023 (phần 2)
- Trắc nghiệm Anken có đáp án năm 2023
- Trắc nghiệm Anken có đáp án năm 2023 (phần 2)
- Trắc nghiệm Ankađien có đáp án năm 2023
- Trắc nghiệm Ankađien có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Anken và Ankađien có đáp án năm 2023
- Trắc nghiệm Luyện tập: Anken và Ankađien có đáp án năm 2023 (phần 2)
- Trắc nghiệm Ankin có đáp án năm 2023
- Trắc nghiệm Ankin có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Ankin có đáp án năm 2023
- Trắc nghiệm Luyện tập: Ankin có đáp án năm 2023 (phần 2)
- Trắc nghiệm Bài thực hành 4: Điều chế và tính chất của etilen và axetilen có đáp án năm 2023
- Trắc nghiệm Bài thực hành 4: Điều chế và tính chất của etilen và axetilen có đáp án năm 2023 (phần 2)
- Đề kiểm tra 1 tiết Hóa học 11 Học kì 2 (Bài kiểm tra số 2) có đáp án năm 2023
- Trắc nghiệm Benzen và đồng đẳng có đáp án năm 2023
- Trắc nghiệm Benzen và đồng đẳng có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Hidrocacbon thơm có đáp án năm 2023
- Trắc nghiệm Luyện tập: Hidrocacbon thơm có đáp án năm 2023 (phần 2)
- Trắc nghiệm Hệ thống hóa về hidrocacbon có đáp án năm 2023
- Trắc nghiệm Hệ thống hóa về hidrocacbon có đáp án năm 2023 (phần 2)
- Trắc nghiệm Ancol có đáp án năm 2023
- Trắc nghiệm Ancol có đáp án năm 2023 (phần 2)
- Trắc nghiệm Phenol có đáp án năm 2023
- Trắc nghiệm Phenol có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Ancol và phenol có đáp án năm 2023
- Trắc nghiệm Luyện tập: Ancol và phenol có đáp án năm 2023 (phần 2)
- Trắc nghiệm Bài thực hành 5: Tính chất của etanol, glixerol và phenol có đáp án năm 2023
- Trắc nghiệm Bài thực hành 5: Tính chất của etanol, glixerol và phenol có đáp án năm 2023 (phần 2)
- Trắc nghiệm Andehit có đáp án năm 2023
- Trắc nghiệm Andehit có đáp án năm 2023 (phần 2)
- Trắc nghiệm Axit cacboxylic có đáp án năm 2023
- Trắc nghiệm Axit cacboxylic có đáp án năm 2023 (phần 2)
- Trắc nghiệm Luyện tập: Andehit, Axit cacboxylic có đáp án năm 2023
- Trắc nghiệm Luyện tập: Andehit, Axit cacboxylic có đáp án năm 2023 (phần 2)
- Trắc nghiệm Bài thực hành 6: Tính chất của andehit và axit cacboxylic có đáp án năm 2023
- Trắc nghiệm Bài thực hành 6: Tính chất của andehit và axit cacboxylic có đáp án năm 2023 (phần 2)
- Trắc nghiệm Ôn tập Học kì 2 có đáp án năm 2023
- Trắc nghiệm Ôn tập Học kì 2 có đáp án năm 2023 (phần 2)
- Trắc nghiệm Đề kiểm tra học kì 2 Hóa học 11 có đáp án năm 2023
Trắc nghiệm Sự điện li có đáp án năm 2023
Câu 1: Phương trình điện li nào sau đây không đúng ?
A. HCl → H+ + Cl-
B. CH3COOH ⇌ CH3COO- + H+
C. H3PO4 → 3H+ + PO43-
D. Na3PO4 → 3Na+ + PO43-
Đáp án: C
Câu 2: Phương trình điện li nào sau đây viết đúng ?
A. H2SO4 ⇌ H+ + HSO4-
B. H2CO3 ⇌ 2H+ + HCO3-
C. H2SO3 → 2H+ + SO32-
D. Na2S ⇌ 2Na+ + S2-
Đáp án: B
Câu 3: Các chất dẫn điện là
A. KCL nóng chảy, dung dịch NaOH, dung dịch HNO3.
B. dung dịch glucozơ , dung dịch ancol etylic , glixerol.
C. KCL rắn khan, NaOH rắn khan, kim cương.
D. Khí HCL, khí NO, khí O3.
Đáp án: A
Câu 4: Dãy các chất đều là chất điện li mạnh là
A. KOH, NaCL, H2CO3.
B. Na2S, Mg(OH)2 , HCl.
C. HClO, NaNO3, Ca(OH)3.
D. HCl, Fe(NO3)3, Ba(OH)2.
Đáp án: D
Câu 5: Trong dung dịch CH3COOH 0,043M, cứ 100 phân tử hòa tan có 2 phân tử phân li thành ion. Nồng độ của ion H+ là
A. 0,001M. B. 0,086M. C. 0,00086M. D. 0,043M.
Đáp án: C
Độ điện li của CH3COOH là 0,02.
CM H+ = 0,043. 0,02 = 0,00086 (mol)
Câu 6: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO42- trong X là
A. 0,2M. B. 0,8M. C. 0,6M. D. 0,4M.
Đáp án: B
Phản ứng điện li:
MgSO4 → Mg2+ + SO42-
Al2(SO4)3 → 2Al3+ + 3SO42-
nSO42- = 0,4 mol
⇒ CM(SO42-) = 0,4 / 0,5 = 0,8 (M)
Câu 7: Trộn 400 ml dung dịch Fe2(SO4)3 0,2M với 100 ml dung dịch FeCl3 0,3m thu được dung dịch Y. Nồng độ ion Fe3+ trong Y là
A. 0.38M. B. 0,22M. C. 0,19M. D. 0,11M.
Đáp án: A
Câu 8: Một dung dịch chứa các ion : Cu2+ (0,02 mol), K+ (0,10 mol), NO3- (0,05 mol) và SO42- (x mol). Giá trị của x là
A. 0,050. B. 0.070. C. 0,030. D. 0,045.
Đáp án: D
Theo bảo toàn điện tích: 2nCu2+ + nK+ = nNO3- + nSO42-
⇒ 2.0,02 + 0,1 = 0,05 + 2x ⇒ x = 0,045 (mol)
Câu 9: Một dung dịch chứa Mg2+ (0,02 mol), K+ (0,03 mol) , Cl- (0,04 mol) và ion Z (y mol). Ion Z và giá trị của y là
A. NO3- (0,03). B. CO32- (0,015). C. SO42- (0,01). D. NH4+ (0,01)
Đáp án: A
Gọi điện tích của ion Z là x, số mol là y
Theo bảo toàn điện tích: 2nMg2+ + nK+ + (-1)nCl- + xy = 0
⇒ xy = -0,03
Vậy Z là anion
Đáp án phù hợp là A: x = -1, y = 0,03 mol. Anion là NO3-
Nếu x = -2, y = 0,015 mol, anion là CO32- loại, vì ion này tạo kết tủa với Mg2+
Câu 10: Dung dịch X gồm : 0,09 mol Cl- , 0,04 mol Na+ , a mol Fe3+ và b mol SO . Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là
A. 0.05 và 0,05. B. 0,03 và 0,02.
C. 0,07 và 0,08. D. 0,018 và 0,027.
Đáp án: B
Theo bảo toàn điện tích: 3a + 0,04 = 0,09 + 2b (1)
Theo bảo toàn khối lượng: 56a + 0,04. 23 + 0,09. 35,5 + 96b = 7,715 (2)
Giải hệ 1 và 2 ⇒ a = 0,03 và b = 0,02
Câu 11: Có 4 dung dịch: Natri clorua, rượu etylic, axit axetic, kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
A. NaCl < C2H5OH < CH3COOH < K2SO4.
B. C2H5OH < CH3COOH < NaCl < K2SO4.
C. C2H5OH < CH3COOH < K2SO4 < NaCl.
D. CH3COOH < NaCl < C2H5OH < K2SO4.
Đáp án: B
Câu 12: Trong dung dịch axit nitric (bỏ qua sự phân li của H2O) có những phần tử nào ?
A. H+, NO3-.
B. H+, NO3-, H2O.
C. H+, NO3-, HNO3.
D. H+, NO3-, HNO3, H2O.
Đáp án: B
Câu 13: Trong dung dịch axit axetic (bỏ qua sự phân li của H2O) có những phần tử nào ?
A. H+, CH3COO-.
B. H+, CH3COO-, H2O.
C. CH3COOH, H+, CH3COO-, H2O.
D. CH3COOH, CH3COO-, H+.
Đáp án: C
Câu 14: Cho các chất: phèn K – Al; C2H5OH; glucozơ; saccarozơ; tinh bột; dầu ăn; CH3COOH; HCOOCH3; CH3CHO; C3H6; Ca(OH)2; CH3COONH4; NaHCO3; KAlO2; C2H4(OH)2; Phèn amoni – sắt. Số chất điện li là:
A. 6 B. 7
C. 9 D. 8
Đáp án: B
Các chất điện li: phèn K – Al (là muối của K và Al); CH3COOH; Ca(OH)2; CH3COONH4; NaHCO3; KAlO2, Phèn amoni – sắt ( muối của sắt và amoni)
Câu 15: Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan. C. CaCl2 nóng chảy.
B. NaOH nóng chảy. D. HBr hòa tan trong nước
Đáp án: A
Trắc nghiệm Axit, bazơ, muối có đáp án năm 2023
Câu 1: Axít nào sau đây là axit một nấc?
A. H2SO4 B. H2CO3 C. CH3COOH D. H3PO4
Đáp án: C
Câu 2: Dãy chất nào sau đây chỉ gồm các hiđrôxit lưỡng tính ?
A. Al(OH)3, Zn(OH)3, Fe(OH)2 B. Zn(OH)2, Sn(OH)2, Pb(OH)2
C. Al(OH)3, Fe(OH)2,Cu(OH)2 D. Mg(OH), Pb(OH)2, Cu(OH)2
Đáp án: B
Câu 3: Cho các dung dịch axit có cùng nồng độ mol: H2S,HCl, H2SO4, H3PO4, dung dịch có nồng độ H lớn nhất là
A. H2SO4 B. H2S C. HCl D. H3PO4
Đáp án: A
Câu 4: Theo thuyết Areniut, kết luận nào sau đây đúng?
A. Bazơ là chất khi tan trong nước phân li cho anion OH.
B. Bazơ là những chất có khả năng phản ứng với axit.
C. Một Bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
D. Bazơ là hợp chất trong thành phần phân tử có một hay nhiều nhóm OH.
Đáp án: A
Câu 5: Theo thuyết Areniut kết luận nào sau đây không đúng?
A. Muối là những hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
B. Muối axit là muối mà anion gốc axit vẫn còn hiđrô có khả năng phân li ra ion H+.
C. Muối trung hòa là muối mà anion gốc axit không còn hiđrô có khả năng phân li ra H+.
D. Hiđrôxít lưỡng tính khi tan vào nước vừa có thể phân li như axit vừa có thể phân li như Bazơ.
Đáp án: A
Câu 6: Cần bao nhiêu ml dung dịch NaOH 0,5M để phản ứng vừa đủ với 50 ml dung dịch NaHCO3 0,2M ?
A. 100 ml.B. 50 ml. C. 40 ml. D. 20 ml.
Đáp án: D
Phản ứng: NaOH + NaHCO3 → Na2CO3 + H2O
⇒ NaOH và NaHCO3 phản ứng theo tỉ lệ 1 : 1.
Ta có: CNaOH.VNaOH = CNaHCO3.VNaHCO3 ⇒ VNaOH = 20 ml
Câu 7: Cho 8 gam hỗn hợp X gồm Mg và Fe vào dung dịch hcl dư. Sau khi phản ứng xảy ra hoàn toàn , khối dung dịch tăng 7,6 gam. Số mol Mg trong X là
A. 0,05 mol. B. 0,075 mol. C. 0,1 mol. D. 0,15 mol.
Đáp án: C
nFe = x mol; nMg = y mol
X + HCl → Muối + H2
mdung dịch tăng = mX – mH2
m2 = 0,4 gam ⇒ nH2 = 0,2 mol
Ta có: nFe + nMg = x + y = nH2 = 0,2 mol (1)
56x + 24y = 8 gam (2)
Từ (1) và (2) ⇒ x = 0,1; y = 0,1 mol
Câu 8: Hòa tan ba muối X, Y, Z vào nước thu được dung dịch chứa: 0,40 mol K+; 0,20 mol Al3+: 0,2 mol SO42- và a mol Cl-. Ba muối X, Y, Z là
A. KCl, K2SO4, AlCl3.
B. KCl, K2SO4, Al2(SO4)3.
C. KCl, AlCl3, Al2(SO4)3.
D. K2SO4, AlCl3, Al2(SO4)3.
Đáp án: C
Bảo toàn điện tích ⇒ a = 0,6
Xét đáp án:
Đáp án A: SO42- chỉ ở K2SO4 ⇒ K+ ở K2SO4 là 0,4 mol (đủ)
⇒ không có KCl ⇒ loại
Đáp án B: Cl- chỉ có ở KCl ⇒ K+ ở KCl là 0,6 mol (dư) ⇒ loại
Đáp án C: 0,4 mol KCl; 0,2/3 mol AlCl3; 0,2/3 mol Al2(SO4)3
⇒ Chọn đáp án C
Đáp án D: Cl- chỉ ở AlCl3 ⇒ Al3+ là 0,2 mol (đủ) ⇒ không có Al2(SO4)3 ⇒ loại
Câu 9: Khi cho 100ml dung dịch NaOH 1M vào 100 ml dung dịch HNO3 xM, thu được dung dịch có chứa 7,6 gam chất tan. Giá trị của x là
A. 1,2. B.0,8. C. 0,6. D. 0,5.
Đáp án: D
nNaOH = 0,1 mol.
Nếu NaOH hết ⇒ mNaNO3 = 0,1. 85 = 8,5g < 7,6 gam chất tan => loại
nHNO3 = 0,1x = nNaOH pư = nNaNO3
⇒ mchất tan = mNaNO3 + mNaOH dư
⇒ 0,1x. 85 + (0,1 – 0,1x). 40 = 7,6
⇒ x = 0,8
Câu 10: Trung hòa 100 gam dung dịch A chứa hỗn hợp HCl và H2SO4 cần vừa đủ 100 ml dung dịch B chứa NaOH 0,8M và Ba(OH)2 0,6M thu được 11,65 gam kết tủa. Nồng độ phần trăm của HCl trong dung dịch A là
A. 7,30% B. 5,84% C. 5,00% D. 3,65%
Đáp án: D
Đặt số mol HCl và H2SO4 lần lượt là x và y
Phản ứng trung hòa: H+ + OH- → H2O
Phản ứng tạo kết tủa: Ba2+ + SO42- → BaSO4
Ta có: nH+ = nOH- ⇒ x + 2y = 0,2
nBaSO4 = 0,05 mol, nBa(OH)2 = 0,06 mol
⇒ Ba2+ dư sau phản ứng, SO42- đã kết tủa hết
⇒ y = nBaSO4 ⇒ x = 0,1 mol
CHCl = 0,1.36.5 / 100 = 3,56%
Câu 11: Theo định nghĩa về axit - bazơ của Bron - stêt có bao nhiêu ion trong số các ion sau đây là bazơ: Na+, Cl-, CO32-, HCO3-, CH3COO-, NH4+, S2- ?
A. 1. B. 2.
C. 3. D. 4.
Đáp án: C
CO32- + 2H2O ⇆ H2CO3 + 2OH-
CH3COO- + H2O ⇆ CH3COOH + OH-
S2- + 2H2O ⇆ H2S + 2OH-
Câu 12: Cho các ion sau:
(a) PO43- (b) CO32- (c) HSO3- (d) HCO3- (e) HPO32-
Theo Bron-stêt những ion nào là lưỡng tính ?
A. (a), (b). B. (b), (c).
C. (c), (d). D. (d), (e).
Đáp án: C
HSO3- + H2O ⇆ H2SO3 + OH-
Axit: HSO3- + H2O ⇆ SO32- + H3O+
HCO3- tương tự
Câu 13: Chọn các chất là hiđroxit lưỡng tính trong số các hiđroxit sau:
A. Zn(OH)2, Cu(OH)2. B. Al(OH)3, Cr(OH)2
C. Sn(OH)2, Pb(OH)2. D. Cả A, B, C.
Đáp án: D
Câu 14: Cho các chất và ion sau: HCO3-, Cr(OH)3, Al, Ca(HCO3)2, Zn, H2O, Al2O3, (NH4)2CO3, HS-, Zn(OH)2, Cr2O3, HPO42-, H2PO4-, HSO3-. Theo Bron-stêt có bao nhiêu chất và ion là lưỡng tính ?
A. 12. B. 11.
C. 13. D. 14.
Đáp án: A
HCO3-, Cr(OH)3, Ca(HCO3)2, H2O, Al2O3, HS-, Zn(OH)2, Cr2O3, HPO42-, H2PO4-, HSO3-
Câu 15: Dãy chất và ion nào sau đây có tính chất trung tính ?
A. Cl-, Na+, NH4+.
B. Cl-, Na+, Ca(NO3)2.
C. NH4+, Cl-, H2O.
D. ZnO, Al2O3, Ca(NO3)2.
Đáp án: B
Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit - bazơ có đáp án năm 2023
Câu 1:Trộn V1 ml dung dịch NaOH có pH = 13 với V2 ml dung dịch Ba(OH)2 có pH = 11, thu được dung dịch mới có pH = 12. Tỉ số V1 : V2 có giá trị là
A. 1/1 B. 2/1 C. 1/10 D. 10/1
Đáp án: C
Ban đầu nOH- = 0,1. V1 + 0,002. V2
pH = 12 ⇒
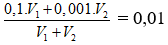
⇒ V1 : V2 = 1/10
Câu 2: Trộn V1 lít dung dịch H2SO4 có pH = 3 với 2 lít dung dịch NaOH có pH = 12, thu được dung dịch mới cố pH = 4. Tỉ số V1 : V2 có giá trị là
A. 8/1 B. 101/9 C. 10/1 D. 4/1
Đáp án: B
Ban đầu nH+ = 0,001.V1; nOH- = 0,01.V2
Dung dịch sau có: pH = 4 ⇒
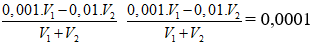
⇒ V1 : V2 = 101/9
Câu 3: Trộn hai dung dịch Ba(HCO3)2 và NaHSO4 có cùng nồng độ mol với nhau theo tỉ lệ thể tích 1 : 1 thu được kết tủa và dung dịch và dung dịch . Bỏ qua sự thủy phân của các ion và sự điện li của nước, các ion cos mặt trong dung dịch Y là
A. Na+ và SO42- B. Ba2+ ,HCO32- và Na+
C. Na+ , HCO32- D. Na+ , HCO32- và SO42-
Đáp án: C
Câu 4: Cho các dung dịch HCl, H2SO4 và CH3COOH có cùng giá trị pH. Sự sqps xếp nào sau đây đúng với giá trị nồng độ mol của các dung dịch trên ?
A. HCl < H2SO4 < CH3COOH
B. H2SO4 < HCl < CH3COOH
C. H2SO4 < CH3COOH < HCl
D. CH3COOH < HCl < H2SO4
Đáp án: B
Câu 5: Chỉ dùng quỳ tím , có thể nhận biết ba dung dịch riêng biệt nào sau đây ?
A. HCl, NaNO3, Ba(OH)2 B. H2SO4, HCl,KOH.
C. H2SO4, NaOH, KOH D. Ba(OH)2, NaCl, H2SO4
Đáp án: A
Câu 6: Chọn câu trả lời đúng, khi nói về muối axit :
A. Dung dịch muối có pH < 7.
B. Muối cố khả năng phản ứng với bazơ.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối mà gốc axit vẫn còn hiđro có khả năng phân li tạo proton trong nước.
Đáp án: D
Câu 7: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là
A. 10 ml. B. 15 ml. C. 20 ml. D. 25 ml.
Đáp án: C
H+ + OH- → H2O
Ta có: ⇒ V = 20 ml.
Câu 8: Dung dịch A có chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ và 0,1 mol Cl- và 0,2 mol NO3 . Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
A. 150 ml. B. 300 ml. C. 200 ml. D. 250 ml.
Đáp án: A
Khi thêm K2CO3 vào dung dịch A, khi lượng kết tủa thu được là lớn nhất tức là toàn bộ Mg2+, Ba2+, Ca2+ đã kết tủa, trong dung dịch còn lại KCl và KNO3
⇒ nK+ = nCl- + nNO3- = 0,3 mol
⇒ nK2CO3 = 0,15 mol
⇒ VK2CO3 = 150 ml
Câu 9: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch
Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330 B. 0,10 và 6,990.
C.0,10 và 4,660 D. 0.05 và 3,495
Đáp án: D
Sau phản ứng trung hòa pH = 1 ⇒ H+ dư
H+ + OH- → H2O
nH+bd = 0,08 mol; sau phản ứng pH = 1
⇒ nH+ sau p/ư = 0,05 mol
nH+p/ư = nOH- = 0,03 mol
⇒ nBa(OH)2 = 0,015 mol
⇒ CM Ba(HCO3)2 = 0,05 (mol/l)
nBaSO4 = nBa(OH)2 = 0,015 mol (H2SO4 dư) ⇒ mBaSO4 = 3,495g
Câu 10: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là
A. 134. B. 147. C. 114. D. 169.
Đáp án: A
Coi 300 ml dung dịch A gồm 100 ml H2SO4 0,1M 100 ml HNO3 0,2M và 100 ml HCl 0,3M trộn lại với nhau. Vậy:
Phản ứng của dung dịch A và B là: H+ + OH- → H2O
nH+ p/ư = nOH- = 0,049.0,001V ⇒ nH+ p/ư = 0,01 (0,3 + 0,001V)
⇒ 0,07 = 0,49.0,001V + 0,010,3 + 0,001V) ⇒ V = 134 ml
Câu 11: Dung dịch có pH = 7 là:
A. NH4Cl. B. CH3COONa.
C. C6H5ONa. D. KClO3.
Đáp án: D
Câu 12: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh ?
A. NaCl. B. NH4Cl.
C. Na2CO3. D. FeCl3.
Đáp án: C
Câu 13: Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng) ?
A. CH3COOH, HCl và BaCl2.
B. NaOH, Na2CO3 và Na2SO3.
C. H2SO4, NaHCO3 và AlCl3.
D. NaHSO4, HCl và AlCl3.
Đáp án: D
Câu 14: Cho các dung dịch muối: Na2CO3 (1), NaNO3 (2), NaNO2 (3), NaCl (4), Na2SO4 (5), CH3COONa (6), NH4HSO4 (7), Na2S (8). Những dung dịch muối làm quỳ hoá xanh là :
A. (1), (2), (3), (4). B. (1), (3), (5), (6).
C. (1), (3), (6), (8). D. (2), (5), (6), (7).
Đáp án: C
(2) (4) (5): trung tính
(7): axit
Câu 15: Cho các muối sau đây: NaNO3; K2CO3; CuSO4; FeCl3; AlCl3; KCl. Các dung dịch có pH = 7 là :
A. NaNO3; KCl.
B. K2CO3; CuSO4; KCl.
C. CuSO4; FeCl3; AlCl3.
D. NaNO3; K2CO3; CuSO4.
Đáp án: A
K2CO3: Bazơ
CuSO4, FeCl3, FeCl2: Axit

