Đề kiểm tra 1 tiết Hóa học 11 Học kì 2 (Bài kiểm tra số 1) có đáp án năm 2021
Đề kiểm tra 1 tiết Hóa học 11 Học kì 2 (Bài kiểm tra số 1) có đáp án năm 2021
Với bộ Đề kiểm tra 1 tiết Hóa học 11 Học kì 2 (Bài kiểm tra số 1) có đáp án năm 2021 sẽ giúp học sinh hệ thống lại kiến thức bài học và ôn luyện để đạt kết quả cao trong các bài thi môn Hóa lớp 11.
Câu 1: Cho dãy các chất : K2SO4, C2H5OH, C12H22O11 (saccarozoơ), CH3COOH, Ba(OH)2, CH3COONH4. Số chất điện li là
A. 3 B. 4 C. 5 D. 2.
Đáp án: D
Câu 2: Dãy gồm các ion cùng tồn tại trong một dung dịch là
A. K+, Ba2+, OH-, Cl- . B. Mg2+ , Ba2+, Cl-, CO32- .
C. Na+, K+, OH-, HCO3- . D. Na+, Ag-, NO3- , Cl-
Đáp án: A
Câu 3: Cho dãy các chất: NaOH, Sn(OH)2, Ph(OH)2, Al(OH)3, Cr(OH)3. Số chất trong dãy có tính chất lưỡng tính là
A. 4 B. 1 C. 3 D. 2.
Đáp án: A
Câu 4: Cho phản ứng hóa học: NaOH + HCl → NaCl + H2O
Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl
B. NaOH + NaHCO3 → Na2CO3 + H2O
C. NaOH + NH4Cl → NaCl + NH3 + H2O
D. KOH + HNO3 → KNO3 + H2O
Đáp án: D
Câu 5: Dung dịch X gồm a mol Na+ ; 0,075 mol K+ ; 0,05 mol HCO3- ;0,075 mol CO32- và 0,025 mol SO42- . Tổng khối lượng muối trong dung dịch X là
A. 16,90 gam B. 14,25 gam C. 14,75 gam D. 15,65 gam.
Đáp án: A
Theo bảo toàn điện tích: a + 0,075 = 0,05 + 2.0,075 + 2.0,025 ⇒ a = 0,175
⇒ mmuối = 0,175.23 + 0,075.39 + 0,05.61 + 0,075.60 + 0,025.96 = 16,9 (gam)
Câu 5:
nH+ = 0,1(0,05.2 + 0,1) = 0,02 mol
nOH- = 0,1(0,2 + 0,1.2) = 0,04 mol
nOH- dư = 0,04 - 0,02 = 0,02 mol.
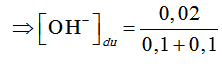
⇒ pOH = 1 ⇒ pH = 13
Câu 6: Trên 100 ml dung dịch hỗn hợp gồm H2SO4 0,5M VÀ HCl 0,1M với 100 mol dung dịch hỗn hợp gồm NaOH 0,2 mol và Ba(OH)2 1M, thu được dung dịch X. dung dịch X có pH là
A.12,8 B. 13,0 C. 1,0 D. 1,2.
Đáp án: A
Câu 7: Nhỏ từ từ 0,25 lít dung dịch NaOH 2,08M vào dung dịch gồm 0,048 mol FeCl3 ; 0,032 mol Al2(SO4)2 và 0,08 mol H2SO4 thu được m gam kết tủa. Giá trị của m là
A. 8,256 B. 5,136 C. 1,560 D. 10,128.
Đáp án: A
nOH- = 0,52 mol
Fe3+ = 0,048 mol; Al3+ = 0,032. 2 = 0,064 mol; nH+ = 0,08. 2 = 0,16 mol
Ta có: nH+ + 3nAl3+ + 3nFe3+ = 0,496 mol < nOH-
⇒ Al(OH)3 sinh ra bị hòa tan bằng OH-, nOH- hòa tan kết tủa = 0,52 – 0,496 = 0,024mol
Al(OH)3 (0,024) + OH- (0,024 mol) → AlO2- + 2H2O
⇒ Al(OH)3 không bị hòa tan = 0,064 – 0,024 = 0,04 mol
m = mAl(OH)3 + mFe(OH)3 = 0,04. 78 + 0,048. 107 = 8,256g
Câu 8: Trong phòng thí nghiệm người tta thường điều chế HNO3 từ
A. NaNO3 và H2SO4 đặc B. NaNO3 và HCl đặc
C. NH3 và O2 D. NaNO2 và H2SO4 đặc.
Đáp án: A
Câu 9: Cho Cu vào dung dịch H2SO4 loãng tác dụng với chất X ( một loại phân bón hóa học ), thấy thoát ra khí không màu hóa rắn trong không khí. Mặt khác , khi X tác dụng với dung dịch NaOH thì cố mùi khai thoát ra. Chất X là
A. amophot B. urê C. natri nitrat D. amoni nitrat.
Đáp án: B
Câu 10: Phản ứng nhiệt phân nào sau đây không đúng ?
A. 2KNO3 →to 2KNO2 + O2 B. NH4NO2 →to N2 + 2H2O
C.NH4Cl →to NH3 + Cl D. NaHCO3 →to NaOH + CO2
Đáp án: D
Câu 11: Thành phần chính của quặng photphoric là
A. Ca3(PO4)2 B. NH4H2PO4 C. Ca(H2PO4)2 D. CaHCO4
Đáp án: A
Câu 12: Hòa tan hoàn toàn một lượng bột Zn vào một dung dịch axit X. Sau phản ứng thi được dung dịch Y và khí Z. Nhỏ từ từ dung dịch NaOH (dư) vào Y. đun nóng thu được khí không màu T. Axit X là
A. H2SO4đặc B. H3PO4 C. H2SO4 loãng D. HNO3.
Đáp án: D
Câu 13: Cho 0,1 mol P2O5 vào dung dịch chứa 0,35 mol KOH. Dung dịch thu được cố các chất
A. K3PO4, K2HPO4 B. K2HPO4, KH2PO4
C. K3PO4, KOH D. H3PO4, KH2PO4
Đáp án: B
Câu 14: Từ 6,2 kg photpho điều chế được bao nhiêu lít dung dịch H3PO4 2M ( hiệu suất toàn bộ quá trình điều chế là 80%) ?
A. 64 lít B. 100 lít C. 40 lít D. 80 lít.
Đáp án: A
P → H3PO4
31 → 98kg
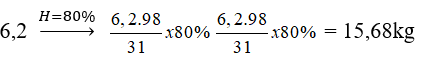
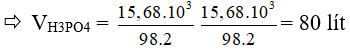
Câu 15: Một loại phân supephotphat kép có chứa 69,62% muối canxi dihiđrophotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 48,52% B. 42,25% C. 39,76% D. 45,75%.
Đáp án: B
Ca(H2PO4)2 → P2O5
234kg → 142kg
69,62% → 69,62% . (142/234) = 42,25%
⇒ Độ dinh dưỡng của phân lân này là 42,25%
Câu 16: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8 đun nóng X thời gian trong bình kín (có bột Fe lam xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là
A. 50% B. 40%
C. 25% D. 36%.
Đáp án: C
Hỗn hợp X có tỉ khối so với He bằng 1,8
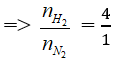
Coi hỗn hợp ban đầu có 4 mol H2 và 1 mol N2 ⇒ Hiệu suất tính theo N2
Áp dụng định luật bảo toàn khối lượng mtrước = msau
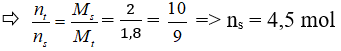
N2 + 3H2 → 2NH3
nkhí giảm = 2nN2 pư = 0,5 mol ⇒ nN2 pư = 0,25 mol
⇒ H% = 25%
Câu 17: Cho m gam bột Fe vào lượng dư dung dịch HNO3, thu được 8,96 lít (đktc) hỗn hợp khí X gồm NO2 và NO có tỉ khối đối với O2 bằng 1,3125. giá trị của m là
A. 5,6 B. 11,2 C. 16,8 D. 2,8.
Đáp án: D
nX = 0,4 mol; MX = 1,3125.32 = 42
X: NO2 (x mol); NO (y mol)
⇒ x + y = 0,4; 46x + 30y = 0,4.42
⇒ x = 0,3; y = 0,1
Bảo toàn electron:
3nFe = nNO2 + nNO = 0,3 + 3.0,1 ⇒ nFe = 0,2 ⇒ m = 11,2 gam
Câu 18: Cho 2,8 gam hỗn hợp X gồm Cu và Ag phản ứng hoàn toàn với dung dịch HNO3 dư, thu được 0,04 mol NO2 (sản phẩm khử duy nhất của N+5) và dung dịch chứa m gam muối. Giá trị của m là
A. 4,48 B. 3,62 C. 3,42 D. 5,28.
Đáp án: D
2HNO3 + 1e → NO2 + NO3- + H2O
mmuối = mKL + 62 = 2,8 + 62.0,04 = 5,28 gam
Câu 19: Hòa tan hoàn toàn 12,42 gam Al bằng dung dịch HNO3 loãng (dư), thu được dung dịch X và 1,344 lít (đktc) hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối của hỗn hợp khí Y so với khí H2 là 18, cô cạn dug dịch X , thu được m gam chất rắn khan. Giá trị của m là
A. 34,08 B. 38,34 C. 106,38 D. 97,98.
Đáp án: C
nY = 0,06 mol; MY = 18.2 = 36; nAl = 0,46 mol
Y: N2O (x mol); N2 (y mol)
⇒ x + y = 0,06; 44x + 28y = 0,06.36
⇒ x = 0,03; y = 0,03
Bảo toàn electron:
3nAl = 8nN20 + 8nNH4NO3 ⇒ nNH4NO3 = 0,105 mol
⇒ m = 0,46.213 + 0,105.80 = 106,38 ( gam)
Câu 20: Phản ứng hóa học, trong đó cacbon có tính khử là
A. 2C + Ca → CaC2 B. C + 2H2 → CH4
C.C + CO2 → 2CO D. 3C + 4Al → Al4C3
Đáp án: C
Câu 21: Phát biểu nào dưới đây không đúng ?
A. SiO2 là oxit axit.
B. dung dịch đậm đặc của NaSiO3 và K2SiO3 được gọi là thủy tinh lỏng.
C. Sục khí CO2 vào dung dịch Ca(OH)2 dư, dung dịch bị vẩn đục.
D. SiO2 tan tốt trong dung dịch HCl.
Đáp án: D
Câu 22: Hấp thụ hoàn toàn 0,336 lít khí CO2 ( đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan ?
A.2,44 gam B. 2,22 gam C. 2,31 gam D. 2,58 gam.
Đáp án: C
nCO2 = 0,015 mol; nOH- = 0,04 mol
nOH- : nCO2 > 2 => Chỉ tạo muối CO32-
nCO32- = nCO2 = 0,015
nOH- dư = nOH- - nOH- pư = 0,04 – 2.0,015 = 0,01
mc/rắn = mCO32- + mK+ + mNa+ + nOH- dư = 0,015.60 + 0,02.39 + 0,02.23 + 0,01.17 = 2,31g
Câu 23: Cho 0,448 lít khí CO2 (ở đktc) hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH 0,06M và Ba(OH)2 0,12M. thu được m gam kết tủa. Giá trị của m là
A. 1,970 B. 1,182 C. 2,364 D. 3,940.
Đáp án: A
nCO2 = 0,02 mol; nOH- = 0,03
⇒ Tạo 2 muối HCO3- (x mol); CO32- (y mol)
CO2 (x) + OH- (x) → HCO3- (x mol)
CO2 (y) + 2OH- (2y) → CO32- (y mol)
nOH- = x + 2y = 0,03
nCO2 = x + y = 0,02
⇒ x = y = 0,01 mol
nBa2+ = 0,012 > nCO32- ⇒ nBaCO3 = nCO32- = 0,01 mol
⇒ m = 0,01.197 = 1,97g
Câu 24: Chất nào sau đây thuộc loại hợp chất hữu cơ ?
A. CaC2 B. C2H2 C. CO2 D. KON.
Đáp án: B
Câu 25: Cặp chất nào dưới đây là dồng phân của nhau ?
A. CH3CH2CH2OH, CH3OCH2CH3 B. CH3OCH3, CH3CHO
C. CH3OH, C2H5OH D. CH3CH2OH, CH3CH2Br
Đáp án: A
Câu 26: Cặp chất nào là đồng đẳng của nhau ?
A. CH3CH, CH3OCH B. CH3OCH3, CH3CHO
C. CH3COOH, C2H5COOH D. CH3CH2OH, CH3CH2CHO
Đáp án: C
Câu 27: Số công thức cấu tạo có thể có ứng với công thức phân tử C3H9N là
A. 7 B. 2 C. 3 D. 4.
Đáp án: D
Câu 28: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 60,0% ; %mH = 8,0%, còn lại là oxi. Tỉ khối hơi của X so với CO2 nhỏ hơn 3. Công thức phân tử của X là
A. C3H8O B. C3H8O2 C. C5H8O2 D. C5H8O.
Đáp án: C
nC : nH : nO = 5 : 8 : 2
Công thức đơn giản nhất: C5H8O2 ⇒ CTPT: (C5H8O2)n
MX = (5.12 + 8 + 32.2)n < 44.3 ⇒ n < 1,32 ⇒ n = 1 ⇒ CTPT: C5H8O2
Câu 29: Đốt cháy hoàn toàn 100 ml hợp chất hữu cơ X, cần hết 300 ml O2, thu được 200 ml CO2 và 300 ml hơi nước. Các khí được đo ở cùng nhiệt độ , áp suất . Công thức phân tử của X là
A. C2H6O B. C2H6O2 C. C2H4O D. C3H6O2.
Đáp án: A
100CxHyOz + 300O2 → 200CO2 + 300H2O
Bảo toàn nguyên tố C: 100x = 200 ⇒ x = 2
Bảo toàn nguyên tố H: 100y = 300.2 ⇒ x = 6
Bảo toàn nguyên tố C: 100z + 300.2 = 200.2 + 200.1 ⇒ z = 1 ⇒ CTPT: C2H6O2
Câu 30: Đốt cháy hoàn toàn 10,4 gam hợp chất hữu cơ X thu được sản phẩm chỉ có CO2 và H2O. Dẫn sản phẩm chạy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đựng dung dịch Ca(OH)2 dư . Sau thí nghiệm , khối lượng bình (1) tăng 3,6 gam, ở bình (2) có 30 gam kết tủa. khi hóa hơi 2,6 gam X, thu được thể tích bằng với thể tích của 0,7 gam N2 đo cùng nhiệt độ , áp suất. Công thức của phân tử X là
A. C8H8 B. C3H4O4 C. C5H12O2 D. C4H8O3.
Đáp án: B
Đặt CTPT của X là CxHyOz
nX = nN2 = 0,025 mol ⇒ MX = 2,6/0,025 = 104
nCO2 = nCaCO3 = 0,3 mol
nH2O = 0,2 mol
nX = 0,1 mol
Bảo toàn nguyên tố C: 0,1.x = 0,3 ⇒ x = 3
Bảo toàn nguyên tố H: 0,1.y = 0,2.2 ⇒ y = 4
12.3 + 4.1 + 16z = 104 ⇒ z = 4 ⇒ CTPT: C3H4O4


