Trắc nghiệm Sắt (Fe) có đáp án năm 2024
Trắc nghiệm Sắt (Fe) có đáp án năm 2024
Với bộ Trắc nghiệm Sắt (Fe) có đáp án năm 2024 sẽ giúp học sinh hệ thống lại kiến thức bài học và ôn luyện để đạt kết quả cao trong các bài thi môn Hóa lớp 12.
Câu 1: Sắt tác dụng với H2O ở nhiệt độ cao hom 570 °C thì tạo ra H2 và sản phẩm rắn là
A. FeO. B. Fe3O4. C. Fe2O3. D. Fe(OH)2.
Đáp án: A
Câu 2: Phản ứng xảy ra khi đốt cháy sắt trong không khí là
A. 3Fe + 2O2 → Fe3O4. B. 4Fe + 3O2 → 2Fe2O3.
C. 2Fe + O2 → 2FeO. D. tạo hỗn hợp FeO, Fe2O3, Fe3O4.
Đáp án: A
Câu 3: Chất nào dưới đây phản ứng với Fe tạo thành hợp chất Fe(II) ?
A. Cl2 B. dung dịch HNO3 loãng
C. dung dịch AgNO3 dư D. dung dịch HCl đặc
Đáp án: D
Câu 4: Dãy các phi kim nào sau đây khi lấy dư tác dụng với Fe thì chỉ oxi hoá Fe thành Fe(III)?
A. Cl2, O2, S B. Cl2, Br2, I2 C. Br2, Cl2, F2 D. O2, Cl2, Br2
Đáp án: C
Câu 5: Nung hỗn hợp gồm 0,3 mol Fe và 0,2 mol S cho đến khi kết thúc phản ứng thu được chất rắn A. Cho A tác dụng với dung dịch HCl dư, thu được khí B. Tỉ khối của B so với không khí là:
A. 0,8045 B. 0,7560 C. 0,7320 D. 0,9800
Đáp án: A
Câu 6: Cho 2,24 gam Fe tác dụng với oxi, thu được 3,04 gam hỗn hợp X gồm 2 oxit. Để hoà tan hết X cần thể tích dung dịch HCl 2M là
A. 25 ml. B. 50 ml. C. 100 ml. D. 150 ml.
Đáp án: B
Áp dụng bảo toàn nguyên tố (mol nguyên tử)
Oxit + HCl → muối clorua + H2O
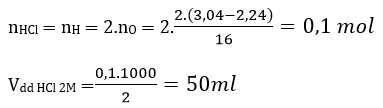
Câu 7: Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của m và V lần lượt là:
A. 10,8 và 4,48. B. 10,8 và 2,24. C. 17,8 và 4,48. D. 17,8 và 2,24.
Đáp án: D
nCu(NO3)2 = 0,8.0,2 = 0,16 mol
nH2SO4 = 0,8.0,25 = 0,2 mol
Do sau phản ứng còn dư hỗn hợp bột kim loại ⇒ Fe còn dư, Cu2+ hết, muối Fe2+

V = 0,1.22,4 – 2,24 lít
m – (0,15 + 0,16).56 + 0,16.64 = 0,6m
m = 17,8
Câu 8: Để m gam bột sắt trong không khí, sau một thời gian thu được 3 gam hỗn hợp oxit X. Hoà tan hết 3 gam X cần vừa đủ 500 ml dung dịch HNO3 X (mol/l), thu được 0,56 lít khí NO (đktc) duy nhất và dung dịch không chứa NH4 . Giá trị của X là
A. 0,27. B. 0,32. C. 0,24. D. 0,29.
Đáp án: B
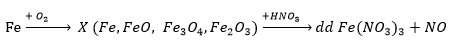
Gọi số mol Fe là a, số mol O2 phản ứng là b
Ta có: 56a + 32b = 3 (1)


Bảo toàn e: 3a = 4b + 0,075
Từ (1) và (2) ta có: a= 0,045; b = 0,015
nHNO3 = nNO3- trong muối nitrat + nN(trong sản phẩm khử)
0,5x = 3. 0,045 + 0,025
x = 0,32 mol
Câu 9: Để điều chế Fe(NO3)2 ta có thể dùng phản ứng nào sau đây ?
A. Fe + dung dịch AgNO3 dư B. Fe + dung dịch Cu(NO3)2
C. FeO + dung dịch HNO3 D. FeS + dung dịch HNO3
Đáp án: B
Câu 10: Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe(III) ?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl
D. Cl2, AgNO3, HNO3 loãng
Đáp án: D
Câu 11: Chia bột kim loại X thành 2 phần. Phần một cho tác dụng với Cl2 tạo ra muối Y. Phần hai cho tác dụng với dung dịch HCl tạo ra muối Z. Cho kim loại X tác dụng với muối Y lại thu được muối Z. Kim loại X có thề là
A. Mg. B. Al. C. Zn. D. Fe.
Đáp án: D
Câu 12: Dung dịch FeSO4 không làm mất màu dung dịch nào sau đây ?
A. Dung dịch KMnO4 trong môi trường H2SO4
B. Dung dịch K2Cr2O7 trong môi trường H2SO4
C. Dung dịch Br2
D. Dung dịch CuCl2
Đáp án: D
Câu 13: Hoà tan hết cùng một lượng Fe trong dung dịch H2SO4 loãng (dư) và dung dịch H2SO4 đặc, nóng (dư) thì các thế tích khí sinh ra lần lượt là V1 và V2 (đo ở cùng điều kiện). Liên hệ giữa V1 và V2 là
A. V1 = V2 B. V1 = 2V2 C. V2 = 1,5V1. D. V2 =3 V1
Đáp án: C
Câu 14: Hoà tan 10 gam hỗn hợp bột Fe và Fe2O3 bằng dung dịch H2SO4 loãng dư thu được 0,672 lít khí (đktc) và dung dịch X. Cho dung dịch X tác dụng vài NaOH dư, thu được kết tủa. Nung kết tủa trong không khí đến khối lượng không đổi được 11,2 gam chất rắn. Thể tích dung dịch KMnO4 0,1M cần phản ứng vừa đủ với dung dịch X là
A. 180 ml. B. 60 ml. C, 100 ml, D, 120 ml.
Đáp án: A
Câu 15: Cho 11,36 gam hồn hợp gồm Fe, FeO, Fe2O3, Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Dung dịch X có thể hoà tan tối đa 12,88 gam Fe. Số mol HNO3 có trong dung dịch ban đầu là
A. 0,88. B.0,64. C. 0,94. , D. 1,04.
Đáp án: C
Gọi số mol Fe là a, số mol O là b, ta được 56a+16b = 11,36 (1)
(Fe + O) → (Fe, FeO, Fe2O3, Fe3O4) −+HNO3→ dd X (Fe3+,H+, NO2- + NO

Ta có: 3a = 2b + 0,18 (2)
Giải hệ (1) và (2) ta được a = 0,16, b = 0,15
Dung dịch X hoà tan Fe theo 2 phản ứng:
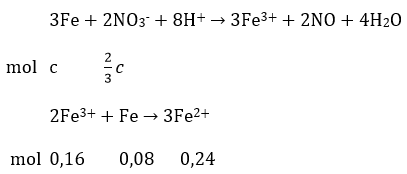
Ta có: c + 0,08 = 0,23mol ⇒ c= 0,15 mol
2c/3=0,10 mol
Bảo toàn nguyên tố N: nHNO3 bđ= nNO3- + nNO = 2nFe2+ + nNO(1) + nNO(2)
nHNO3 = 2.(0,15 + 0,24) + 0,06 + 0,10 = 0,94 mol
Câu 16: Để a gam bột Fe trong không khí một thời gian, thu được 9,6 gam chất rắn X. Hoà tan hoàn toàn X trong dung dịch HNO3 loãng (dư), thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của ). Cho dung dịch NaOH dư vào Y, thu được kết tủa, Lọc kết tủa rồi nung ở nhiệt độ cao đến khối lượng không đổi, thu được 12,0 gam chất rắn. Số mol HNO3 đã phản ứng là:
A. 0,75. B. 0,65. C. 0,55. D. 0,45.
Đáp án: C
(a gam Fe + O) → 9,6 gam X (Fe, FeO, Fe2O3, Fe3O4)
−+HNO3→ dd Y (Fe3+,H+,NO33- )+NO)
Y + NaOH(dư) → Fe(OH)3 → Fe2O3 (12 gam)
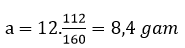
mO = 9,6 – 8,4 = 1,2 gam
⇒ nFe = 0,15 mol; nO = 0,075 mol
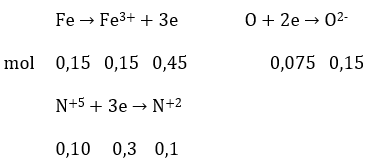
nHNO3 pứ = 0,45 + 0,1 = 0,55 mol


