Đề thi học kì 1 Hóa học 11 có đáp án (Tự luận)
Đề thi học kì 1 Hóa học 11 có đáp án (Tự luận)
Với Đề thi học kì 1 Hóa học 11 có đáp án (Tự luận) được tổng hợp chọn lọc từ đề thi môn Hoá học 11 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hoá học lớp 11.

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2024
Môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(Đề số 1)
Câu 1: (2 điểm) Viết phương trình phân tử và phương trình ion rút gọn của các phản ứng xảy ra giữa các cặp chất sau:
1. Na3PO4 + AgNO3
2. K2CO3 + HCl
3. MgCl2 + Ca(OH)2
4. CuSO4 + BaCl2
Câu 2: (2 điểm) Hòa tan 0,62 gam Na2O vào nước dư thu được 2 lít dung dịch A. Tính giá trị pH của dung dịch A.
Câu 3: (2 điểm) Bằng phương pháp hóa học, hãy phân biệt các dung dịch chứa trong các lọ mất nhãn sau: NH4Cl, K3PO4, NaCl, AgNO3. Viết phương trình hóa học các phản ứng xảy ra nếu có.
Câu 4: (3 điểm) Cho 11,8 gam hỗn hợp gồm Al và Cu hòa tan vừa đủ trong 400 ml dung dịch HNO3 đặc, nóng. Sau phản ứng thu được 17,92 lít khí NO2 (đktc). Hãy tính:
1. Phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
2. Khối lượng muối thu được sau phản ứng.
Câu 5: (1 điểm) Hợp chất hữu cơ X (chứa 3 nguyên tố C, H, O) có phần trăm khối lượng C, H và O lần lượt bằng 64,86%, 13,51% và 21,63%.
Khối lượng mol phân tử của X bằng 74,0 g/mol. Hãy lập công thức phân tử của X.
(Cho biết: Na = 23, Al = 27, Cu = 64, H = 1, N = 14, O = 16, C = 12)
Đáp án và Thang điểm
Câu 1: (2 điểm)
a. Na3PO4 + AgNO3
+ Phương trình phân tử:
Na3PO4 + 3AgNO3 → Ag3PO4 + 3NaNO3
+ Phương trình ion rút gọn:
PO43- + 3Ag+ → Ag3PO4
b. K2CO3 + HCl
+ Phương trình phân tử:
K2CO3 + 2HCl → 2KCl + CO2 + H2O
+ Phương trình ion rút gọn:
CO32- + 2OH- → CO2 + H2O
c. MgCl2 + Ca(OH)2
+ Phương trình phân tử:
MgCl2 + Ca(OH)2 → CaCl2 + Mg(OH)2
+ Phương trình ion rút gọn:
Mg2+ + 2OH– → Mg(OH)2
d. CuSO4 + BaCl2
+ Phương trình phân tử:
CuSO4 + BaCl2 → CuCl2 + BaSO4
+ Phương trình ion rút gọn:
SO42- + Ba2+ → BaSO4
Câu 2: (2 điểm)
Số mol Na2O: n = 0,01 mol
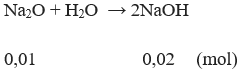
Nồng độ mol NaOH: CM = 0,01 M
[OH–] = 0,01 M
Ta có: [OH-].[OH–] = 10-14
[OH-] = 10-12 (M)
Giá trị pH của dung dịch A: pH = -lg[OH-] = -lg10-12 = 12
Câu 3: (2 điểm)
Lấy 4 mẫu thử: NH4Cl, K3PO4, NaCl, AgNO3
– Cho dung dịch AgNO3 vào 4 mẫu thử:
+ Mẫu xuất hiện kết tủa vàng là: K3PO4
Phương trình phản ứng : K3PO4 + 3AgNO3 → Ag3PO4 + 3KNO3
+ Mẫu xuất hiện kết tủa trắng là : NH4Cl, NaCl (*)
Phương trình phản ứng :
NH4Cl + AgNO3 → AgCl + NH4NO3 ;
NaCl + AgNO3 → AgCl + NaNO3
+ Mẫu không hiện tượng là : AgNO3
– Cho tiếp dung dịch KOH vào (*), đun nhẹ
+ Mẫu xuất hiện khí mùi khai là : NH4Cl
Phương trình phản ứng: NH4Cl + NaOH → NaCl + NH3 + H2O
+ Mẫu không hiện tượng là: NaCl
Câu 4: (3 điểm)
nNO2 = 0,8 mol
– Gọi x, y lần lượt là số mol của Al, Cu trong hỗn hợp ban đầu
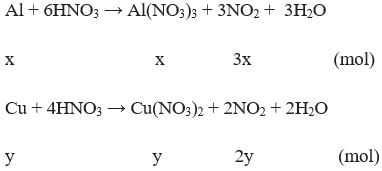
Theo đề bài ta có hệ pt:
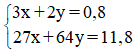
Giải hệ ta được: x = 0,2 ; y = 0,1
a. Phần trăm khối lượng Al: %Al = 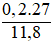
Phần trăm khối lượng Cu: %Cu = 100% – 45,76% = 54,24%
b. mmuối = 0,2 . 213 + 0,1 . 188 = 61,4 (g)
Câu 5: (1 điểm)
Đặt công thức phân tử của X là: CxHyOz
Lập tỉ lệ: x : y : z = 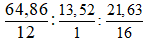
⇒ Chọn x = 4 ; y = 10 ; z = 1
CTPT X: (C4H10O)n
Theo bài: MX = 74 ⇒ 74.n = 74 ⇒ n = 1
⇒ CTPT: C4H10O
