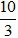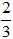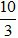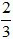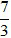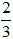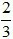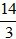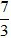Đề thi Hóa học 11 Học kì 1 có đáp án năm 2024 (hay nhất)
Haylamdo biên soạn và sưu tầm Trọn bộ 30 đề thi Hóa học 11 Cuối kì 1 sách mới Kết nối tri thức, Chân trời sáng tạo, Cánh diều có đáp án và ma trận sẽ giúp bạn ôn tập và đạt điểm cao trong bài thi Hóa học 11.
Đề thi Hóa học 11 Cuối kì 1 năm 2024 có đáp án (30 đề)
MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I - Năm học 2024
MÔN HÓA: 11
(Trắc nghiệm 30 câu ×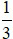 điểm = 10,0 điểm)
điểm = 10,0 điểm)
Chủ đề |
CẤP ĐỘ |
||
Nhận biết |
Thông hiểu |
Vận dụng |
|
1. Sự điện li |
- Biết chất điện li mạnh, yếu. - Biết được axit, bazơ, muối, hiđroxit lưỡng tính. - Biết được môi trường theo pH. |
- Hiểu bản chất, điều kiện xảy ra phản ứng trao đổi ion trong dung dịch chất điện li. |
- Tính pH của dung dịch. - Viết được phương trình ion thu gọn. - Giải một số bài tập theo phương pháp bảo toàn điện tích. |
|
Số câu: 10 Số điểm: Tỉ lệ%: 33,33% |
Số câu: 5 Số điểm: Tỉ lệ: 16,67% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
2. Nitơ - photpho |
- Biết tính chất hóa học, ứng dựng, điều chế nitơ. - Biết tính chất hóa học của amoniac, muối amoni. - Phương pháp điều chế N2, NH3, HNO3. - Biết tính chất hóa học của P và H3PO4. - Biết vai trò các loại phân bón và biết một số loại phân bón cơ bản. |
- Hiểu được tính chất hóa học của axit HNO3, tính chất của các muối nitrat. - Biết được cách tính độ dinh dưỡng của phân bón. |
Giải bài tập bảo toàn electron khi cho kim loại tác dụng với HNO3. - Giải bài tập khi cho dung dịch kiềm như NaOH, KOH tác dụng với H3PO4. - Giải một số bài tập tìm kim loại hoặc xác định sản phẩm khử của nitơ. - Giải bài tập về tổng hợp NH3. |
|
Số câu: 10 Số điểm: Tỉ lệ%: 33,33% |
Số câu: 4 Số điểm: Tỉ lệ: 13,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
3. Cacbon và hợp chất của các bon |
Biết được tính chất hóa học và ứng dụng của cacbon và một số hợp chất hay gặp. |
- Giải bài tập về CO khử oxit kim loại. - Giải bài tập về muối cacbanat |
|
|
Số câu: 3 Số điểm: 1 Tỉ lệ%: 10% |
Số câu: 2 Số điểm: Tỉ lê: 6,67% |
Số câu: 1 Số điểm: Tỉ lê: 3,33% |
|
4. Đại cương hóa học hữu cơ |
- Biết một số đặc điểm của hợp chất hữu cơ. - Biết cách phân loại hợp chất hữu cơ. - Nắm được khái niệm công thức phân tử, công thức đơn giản nhất. |
- Hiểu được đồng đẳng, đồng phân. - Biết cách viết công thức cấu tạo. |
- Giải bài tập xác định công thức phân tử theo % khối lượng và từ công thức đơn giản nhất. - Vận dụng phương pháp bảo toàn nguyên tố, bảo toàn khối lượng giải bài tập đốt cháy hợp chất hữu cơ. |
|
Số câu: 7 Số điểm: Tỉ lệ%: 23,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
|
Tổng số câu: 30 Tổng số điểm: 10 Tỉ lệ% = 100% |
Số câu: 14 Số điểm: Tỉ lệ: 46,67% |
Số câu: 7 Số điểm: Tỉ lệ: 23,33% |
Số câu: 9 Số điểm: 3 Tỉ lệ: 30% |
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2024
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Theo A-rê-ni-ut, chất nào sau đây là bazơ?
A. KOH. B. CH3COONa. C. H2SO4. D. NaCl.
Câu 2: Chất nào sau đây thuộc loại chất điện li mạnh?
A. H2O. B. NaCl. C. C2H5OH. D. CH3COOH.
Câu 3: Hợp chất nào sau đây có tính lưỡng tính?
A. Al(OH)3. B. Ba(OH)2. C. Fe(OH)2. D. Cr(OH)2.
Câu 4: Dung dịch chất nào sau đây làm xanh quỳ tím?
A. Na2SO4. B. NaOH. C. HCl. D. KCl.
Câu 5: Cho các muối sau đây: NaNO3; K2CO3; CuSO4; FeCl3; AlCl3; KCl. Các dung dịch có pH = 7 là:
A. NaNO3; KCl. B. K2CO3; CuSO4; KCl.
C. CuSO4; FeCl3; AlCl3. D. NaNO3; K2CO3; CuSO4.
Câu 6: Một dung dịch chứa các ion: Cu2+ (0,02 mol), K+ (0,10 mol), NO3- (0,05 mol) và SO42- (x mol). Giá trị của x là:
A. 0,050. B. 0.070. C. 0,030. D. 0,045.
Câu 7: Cho dung dịch chứa các ion sau: Na+, Ca2+, Mg2+, Ba2+, H+, NO3-. Muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào dung dịch người ta dùng:
A. dung dịch K2CO3vừa đủ. B. dung dịch Na2SO4 vừa đủ.
C. dung dịch KOH vừa đủ. D. dung dịch Na2SO3 vừa đủ.
Câu 8: A là dung dịch HNO3 0,01M; B là dung dịch H2SO4 0,005M. Trộn các thể tích bằng nhau của A và B được dung dịch X. Tính pH của dung dịch X
A. 1 B. 2 C. 3 D. 4
Câu 9: Phương trình ion rút gọn: H+ + HCO3- → CO2 ↑ + H2O
Tương ứng với phương trình hóa học dạng phân tử nào sau đây?
(1) 2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
(2) 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
(4) Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 ↑ + 2H2O
A. 1, 2 B. 2, 3 C. 2, 4 D. 1, 3
Câu 10: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. AlCl3 và Na2CO3. B. HNO3 và NaHCO3.
C. NaAlO2 và KOH. D. NaCl và AgNO3.
Câu 12: Trong phản ứng nào sau đây, nitơ thể hiện tính khử?
A. N2 + 3H2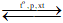 2NH3
2NH3
B. N2 + 6Li −to→ 2Li3N
C. N2 + O2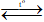 2NO
2NO
D. N2 + 3Mg −to→ Mg3N2
Câu 13: Hàm lượng KCl có trong một loại phân kali có độ dinh dưỡng 50% là:
A. 79,26%. B. 95.51%. C. 31,54%. D. 26,17%.
Câu 14: Cho 44 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn. Đem cô cạn dung dịch đến khô, thu được lượng muối khan là:
A. 50 gam Na3PO4.
B. 15 gam Na2HPO4.
C. 19,2 gam NaH2PO4 và 14,2 gam NaH2PO4.
D. 14,2 gam NaH2PO4 và 49,2 gam Na3PO4.
Câu 15: Cho 8 gam Cu tác dụng với 120 ml dung dịch X gồm HNO3 1M và H2SO4 0,5M thu được V lít khí NO (đktc). Tính V?
A. 1,244 lít B. 1,68 lít C. 1,344 lít D. 1,12 lít
Câu 16: Trong các nhận định sau nhận định nào đúng:
A. Mặc dù độ âm điện của photpho nhỏ hơn nitơ nhưng photpho hoạt động hóa học mạnh hơn nitơ là do liên kết trong phân tử photpho kém bền hơn trong phân tử nitơ.
B. Nitơ hoạt động hóa học yếu hơn photpho là do nitơ có độ âm điện kém hơn photpho.
C. Ở nhiệt độ thường, nitơ và photpho đều trơ về mặt hóa học.
D. Nitơ có độ âm điện nhỏ hơn photpho nên hoạt động hóa học mạnh hơn.
Câu 17: Cacbon vô định hình được điều chế từ than gỗ hay gáo dừa có tên là than hoạt tính. Tính chất nào của than hoạt tính giúp con người chế tạo các thiết bị phòng độc, lọc nước?
A. Than hoạt tính dễ cháy.
B. Than hoạt tính có cấu trúc lớp.
C. Than hoạt tính có khả năng hấp phụ cao.
D. Than hoạt tính có khả năng hòa tan tốt trong nhiều dung môi.
Câu 18: X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3. B. (NH4)2SO3.
C. NH4HSO3. D. (NH4)3PO4.
Câu 19: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng là:
A. 20%. B. 22,5%. C. 25%. D. 27%.
Câu 20: Trong phòng thí nghiệm thường điều chế HNO3 bằng phản ứng:
A. NaNO3 + H2SO4 (đ) −to→ HNO3 + NaHSO4.
B. 4NO2 + 2H2O + O2 → 4HNO3.
C. N2O5 + H2O → 2HNO3.
D. 2Cu(NO3)2 + 2H2O → Cu(OH)2 + 2HNO3.
Câu 21: Trong bình kín chứa 0,5 mol CO và m gam Fe3O4. Đun nóng bình cho tới khi phản ứng xảy ra hoàn toàn thì khí trong bình có tỉ khối so với khí CO ban đầu là 1,457. Giá trị của m là:
A. 17,4. B. 11,6. C. 22,8. D. 23,2.
Câu 22: Cho P tác dụng với Ca, sản phẩm thu được là:
A. Ca3P2. B. Ca2P3. C. Ca3(PO4)2. D. CaP2.
Câu 23: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 −to→ CO2. B. C + 2CuO −to→ 2Cu + CO2.
C. 3C + 4Al −to→ Al4C3. D. C + H2O −to→ CO + H2.
Câu 24: Cho hình vẽ thí nghiệm phân tích định tính hợp chất hữu cơ C6H12O6:
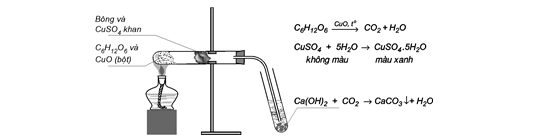
Hãy cho biết vai trò của bông và CuSO4 khan trong thí nghiệm trên?
A. Xác định sự có mặt của O. B. Xác định sự có mặt của C và H.
C. Xác định sự có mặt của H. D. Xác định sự có mặt của C.
Câu 25: Những hợp chất có thành phần phân tử hơn kém nhau một hoặc nhiều nhóm nhưng có tính chất hóa học tương tự nhau được gọi là:
A. Đồng đẳng. B. Đồng phân.
C. Hiđrocacbon. D. Thù hình.
Câu 26: Cho những chất sau: NaHCO3 (1); CH3COONa (2); H2C2O4 (3); CaC2 (4); Al4C3 (5); C2H5OH (6); C2H5Cl (7). Những chất hữu cơ là:
A. (1), (2), (4), (5). B. (1), (4), (5) và (6).
C. (1), (3), (4), (5), (6) và (7). D. (2), (3), (6) và (7).
Câu 27: Phân tích định lượng m gam hợp chất hữu cơ X thấy tỉ lệ khối lượng giữa 4 nguyên tố C, H, O, N là mC : mH : mO : mN = 4,8 : 1 : 6,4 : 2,8. Công thức đơn giản nhất của X là:
A. CH2ON. B. C2 H6O2N. C. C2 H5O2N. D. C3 H4O2N
Câu 28: Đốt cháy hoàn toàn 3,72 gam chất hữu cơ A thu được 10,56 gam CO2 và 2,52 gam H2O; 0,448 lít N2 (đktc). Biết MA = 93 đvC. A có công thức phân tử là:
A. C3H7O2N. B. C7H7N. C. C6H7N. D. C6H5ON.
Câu 29: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. cộng hóa trị B. ion C. kim loại D. hiđro.
Câu 30: Cặp chất nào sau đây là đồng phân của nhau?
A. C2H5OH, CH3OCH3. B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH. D. CH3CH2Cl, CH3CH2OH.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2024
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Dãy các chất đều là chất điện li mạnh là
A. KOH, NaCl, H2CO3. B. Na2S, Mg(OH)2 , HCl.
C. HClO, NaNO3, Ca(OH)2. D. HCl, Fe(NO3)3, Ba(OH)2.
Câu 2: Một dung dịch chứa Mg2+ (0,02 mol), K+ (0,03 mol), Cl- (0,04 mol) và ion Z (y mol). Ion Z và giá trị của y là:
A. NO3- (0,03). B. CO32- (0,015).
C. SO42- (0,01). D. NH4+ (0,01).
Câu 3: Dãy chất nào sau đây chỉ gồm các hiđroxit lưỡng tính?
A. Al(OH)3, Zn(OH)2, Fe(OH)2. B. Zn(OH)2, Sn(OH)2, Pb(OH)2.
C. Al(OH)3, Fe(OH)2,Mg(OH)2. D. Mg(OH), Pb(OH)2, Fe(OH)2.
Câu 4: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. AlCl3 và Na2CO3. B. HNO3 và NaHCO3.
C. NaAlO2 và KOH. D. NaCl và AgNO3.
Câu 5: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + OH- → H2O?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4↓
D. H2SO4 + Ba(OH)2 → 2H2O + BaSO4↓
Câu 6: Cho 15 ml dung dịch HNO3 có pH = 2 trung hòa hết 10 ml dung dịch Ba(OH)2 có pH = a. Giá trị của a là:
A.13 B. 12,4 C.12,2 D.12,5
Câu 7: Phương trình điện li viết đúng là:
A. CH3COOH → CH3COO- + H+ B. C2H5OH → C2H5+ + OH-
C. NaCl → Na2+ + Cl2- D. Ba(OH)2 → Ba2+ + 2OH-
Câu 8: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh?
A. NaCl. B. NH4Cl. C. Na2CO3. D. FeCl3.
Câu 9: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là
A. Ca2+, Cl-, Na+, CO32-. B. Al3+, SO42-, Cl-, Ba2+.
C. Na+, OH-, HCO3-, K+. D. K+, Ba2+, OH-, Cl-.
Câu 10: Dung dịch A có a mol NH4+, b mol Mg2+, c mol SO42- và d mol HSO3- . Biểu thức nào dưới đây biểu thị đúng sự liên quan giữa a, b, c, d?
A. a + 2b = c + d B. a + 2b = 2c + d
C. a + b = 2c + d D. a + b = c + d
Câu 11: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2. B. Al, H2 và Mg.
C. NaOH, H2 và Cl2. D. HI, O3 và Mg.
Câu 12: Muối được làm bột nở trong thực phẩm là
A. (NH4)2CO3. B. Na2CO3. C. NH4HSO3. D. NH4Cl.
Câu 13: Cho các phát biểu sau:
(1) Độ dinh dưỡng của phân đạm, phân lân và phân kali tính theo phần trăm khối lượng tương ứng của N2O5; P2O5 và K2O.
(2) Người ta không bón phân urê kèm với vôi.
(3) Phân lân chứa nhiều photpho nhất là supephotphat kép.
(4) Bón nhiều phân đạm amoni sẽ làm đất chua.
(5) Quặng photphorit có thành phần chính là Ca3(PO4)2.
Trong các phát biểu trên, số phất biểu đúng là
A. 5. B. 2. C. 3. D. 4.
Câu 14: Hoà tan hoàn toàn 12,8 gam Cu trong dung dịch HNO3 thấy thoát ra V lít hỗn hợp khí A gồm NO, NO2 (đktc). Biết tỉ khối hơi của A so với H2 là 19. Giá trị của V là:
A. 4,48 lít B. 2,24 lít
C. 0,448 lít D. Kết quả khác
Câu 15: Khi cho clo dư qua photpho nóng chảy, sẽ thu được sản phẩm nào sau đây:
A. PCl3 B. PCl5 C. PCl2 D. PCl
Câu 16: Tính khử của cacbon thể hiện trong phản ứng nào sau đây?
A. 2C + Ca −to→ CaC2. B. C + 2H2 −to→ CH4.
C. C + CO2 −to→ 2CO. D. 3C + 4Al → Al4C3.
Câu 17: Một loại đá vôi chứa 80% CaCO3 còn lại là tạp chất trơ. Nung m gam đá này một thời gian thu được 0,78m gam chất rắn. Hiệu suất phân hủy CaCO3 là:
A. 78%. B. 50%. C. 62,5%. D. 97,5%.
Câu 18: Để thu được muối photphat trung hòa, cần V ml dung dịch NaOH 1M cho tác dụng với 50 ml dung dịch H3PO4 0,5M. Giá trị của V là:
A. 75 ml. B. 100 ml. C. 50 ml. D. 25 ml.
Câu 19: Khi đốt cháy than đá, thu được hỗn hợp khí trong đó có khí X (không màu, không mùi, độc). X là khí nào sau đây?
A. CO2. B. CO. C. SO2. D. NO2.
Câu 20: Nhỏ dung dịch bạc nitrat vào dung dịch natri photphat đựng trong ống nghiệm thì xuất hiện kết tủa màu
A. trắng. B. vàng. C. đen. D. nâu.
Câu 21: Hàm lượng KCl có trong một loại phân kali có độ dinh dưỡng 50% là
A. 79,26%. B. 95.51%. C. 31,54%. D. 26,17%
Câu 22: Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2. B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc. D. NaNO2 và HCl đặc.
Câu 23: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 −to→ CO2. B. C + 2CuO −to→ 2Cu + CO2.
C. 3C + 4Al −to→ Al4C3. D. C + H2O −to→ CO + H2.
Câu 24: Trong thành phần phân tử, hợp chất hữu cơ nhất thiết phải có nguyên tố:
A. cacbon B. hiđro C. oxi D. nitơ.
Câu 25: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 54,54%; %mH = 9,09% còn lại là oxi. Tỉ khối hơi của X so với CO2 bằng 2. Công thức phân tử của X là:
A. C5H12O B. C2H4O C. C3H4O3 D. C4H8O2.
Câu 26: Cặp chất nào sau đây là đồng đẳng của nhau?
A. CH3OH, CH3OCH3. B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH. D. CH3CH2OH, C3H6(OH)2.
Câu 27: Số công thức tạo mạch hở có thể có ứng với công thức phân tử C4H8 là:
A. 1 B. 2 C. 3 D. 4.
Câu 28: Phản ứng hóa học của các chất hữu cơ thường:
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Câu 29: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X (C, H, O). Cần vừa đủ 6,72 lít O2 (đktc), thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 34,78% B. 69,56% C. 76,19 % D. 67,71%
Câu 30: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. ion B. cộng hóa trị C. kim loại D. hiđro.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2024
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Hợp chất nào sau đây có tính lưỡng tính?
A. Al(OH)3. B. Ba(OH)2. C. Fe(OH)2. D. Cr(OH)2.
Câu 2: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO42- trong X là
A. 0,2M. B. 0,8M. C. 0,6M. D. 0,4M.
Câu 3: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330. B. 0,10 và 6,990.
C.0,10 và 4,660. D. 0.05 và 3,495.
Câu 4: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là:
A. 10 ml. B. 15 ml. C. 20 ml. D. 25 ml.
Câu 5: Phương trình điện li nào sau đây viết đúng?
A. H2SO4⇄ H+ + HSO4- B. H2CO3⇄ 2H+ + HCO3-
C. H2SO3 → 2H+ + SO32- D. Na2S ⇄ 2Na+ + S2-
Câu 6: Axit nào sau đây là axit một nấc?
A. H2SO4 B. H2CO3 C. CH3COOH D. H3PO4
Câu 7: A là dung dịch HNO3 0,01M; B là dung dịch H2SO4 0,005M. Trộn các thể tích bằng nhau của A và B được dung dịch X. Tính pH của dung dịch X
A. 1 B. 2 C. 3 D. 4
Câu 8: Phương trình: S2-+ 2H+ → H2S là phương trình ion rút gọn của phản ứng nào?
A. FeS + 2HCl → FeCl2 + H2S↑.
B. 2NaHSO4 + 2Na2S → 2Na2SO4 + H2S↑
C. 2HCl + K2S → 2KCl + H2S↑.
D. BaS + H2SO4 → BaSO4↓ + H2S↑.
Câu 9: Cho các dung dịch axit có cùng nồng độ mol: H2S, HCl, H2SO4, H3PO4, dung dịch có nồng độ H+ lớn nhất là:
A. H2SO4 B. H2S C. HCl D. H3PO4
Câu 10: Cho 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion trong các ion sau: Ba2+, Al3+, Na+, Ag+, CO32-, NO3-, Cl-, SO42-. Các dung dịch đó là:
A. BaCl2, Al2(SO4)3, Na2CO3, AgNO3.
B. Ba(NO3)2, Al2(SO4)3, Na2CO3, AgCl.
C. BaCl2, Al2(SO4)3, Na2CO3, AgNO3.
D. Ba(NO3)2, Al2(SO4)3, NaCl, Ag2CO3.
Câu 11: Trong công nghiệp, N2 được tạo ra bằng cách nào sau đây?
A. Nhiệt phân muối NH4NO3 đến khối lượng không đổi.
B. Chưng cất phân đoạn không khí lỏng.
C. Phân hủy NH3.
D. Đun nóng Mg với dung dịch HNO3 loãng.
Câu 12: Tìm phản ứng viết sai:
A. NH4NO3 −to→ NH3 + HNO3
B. (NH4)2CO3 −to→ 2NH3 + CO2 + H2O
C. NH4Cl −to→ NH3 + HCl
D. NH4HCO3 −to→ NH3 + CO2 + H2O
Câu 13: Cho những cặp chất sau: (1) C và CO, (2) CO2 và dung dịch Ba(OH)2, (3) CO và CaO, (4) CO2 và Al. Các cặp chất không có phản ứng xảy ra là:
A. (1) và (3). B. (2) và (3). C. (3) và (4). D. (1) và (2).
Câu 14: Loại phân đạm nào sau đây có độ dinh dưỡng cao nhất?
A. (NH4)2SO4. B. (NH2)2CO. C. NH4NO3. D. NH4Cl.
Câu 15: Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng trong dung dịch chứa:
A. KH2PO4 và K3PO4. B. K2HPO4 và K3PO4.
C. KH2PO4 và K2HPO4. D. K3PO4 và KOH dư.
Câu 16: Cho các chất KNO3, Fe(NO3)3, Zn(NO3)2, Fe(NO3)2. Số chất khi bị nhiệt phân thu được hỗn hợp khí NO2, O2 là:
A. 4. B. 3 C. 2 D. 1
Câu 17: Điều khẳng định nào sau đây đúng khi nói về tính chất hóa học của NH3. NH3 có:
A. tính oxi hoá B. tính khử và tính bazơ yếu
C. tính khử D. tính bazơ yếu
Câu 18: Hòa tan hỗn hợp gồm 0,1 mol Al và 0,2 mol Zn bằng 500 ml dung dịch HNO3 vừa đủ, thu được dung dịch A và không thấy khí thoát ra. Cô cạn dung dịch A thu m gam muối. Giá trị của m là:
A. 51,9 gam B. 66,1 gam
C. 59,1 gam D. 61,6 gam
Câu 19: Tìm phương trình hóa học viết sai?
A. 2P + 3Ca −to→ Ca3P2 B. 4P + 5O2 (dư) −to→ 2P2O5
C. PCl3 + 3H2O → H3PO3 + 3HCl D. P2O3 + 3H2O → 2H3PO4
Câu 20: Kim loại Cu tan trong dung dịch axit HNO3 nhận thấy thoát ra khí X có màu nâu đỏ, là sản phẩm khử duy nhất. Vậy X là
A. NO. B. NO2. C. N2. D. N2O.
Câu 21: Tính bazơ của NH3 do:
A. Trên nitơ còn cặp e tự do.
B. Phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan được nhiều trong H2O.
D. NH3 tác dụng với H2O tạo NH4OH.
Câu 22: Nung hoàn toàn 10 gam CaCO3 ở 10000C thu được V lít khí CO2 thoát ra ở đktc. Giá trị của V là:
A. 2,24 lít. B. 1,12 lít. C. 0,112 lít. D. 4,48 lít.
Câu 23: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 −to→ CO2. B. C + 2CuO −to→ 2Cu + CO2.
C. 3C + 4Al −to→ Al4C3. D. C + H2O −to→ CO + H2.
Câu 24: Hợp chất hữu cơ được phân loại như sau:
A. Hiđrocacbon và hợp chất hữu cơ có nhóm chức.
B. Hiđrocacbon và dẫn xuất của hiđrocacbon.
C. Hiđrocacbon no, không no, thơm và dẫn xuất của hiđrocacbon.
D. Tất cả đều đúng.
Câu 25: Chất nào sau đây là dẫn xuất của hiđrocacbon?
A. CH4 B. C2H6 C. C6H6 D. C3H6Br.
Câu 26: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X (C, H, O), thu được 8,96 lít CO2 (đktc) và 7,2 gam H2O. Biết tỉ khối của X so với CO2 là 2. Công thức phân tử của X là:
A. C2H4O B. C5H12O C. C4H8O2 D. C3H4O3.
Câu 27: Phản ứng hóa học của các chất hữu cơ thường:
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Câu 28: Khi phân tích một hợp chất hữu cơ (X) có thành phần như sau: %C = 52,17%; %H = 13,04% và %O = 34,78%. Biết công thức đơn giản nhất trùng với công thức phân tử. Công thức phân tử của (X) là:
A. C2H6O. B. C3H8O. C. CH4O. D. C4H10O.
Câu 29: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3. B. CH3OCH3, CH3CHO.
C. CH3CH2CH2OH, C2H5OH. D. C4H10, C6H6.
Câu 30: Số công thức cấu tạo có thể có ứng với các công thức phân tử C4H10 là:
A. 1 B. 2 C. 3 D. 4.
--- Hết ---
Giám thị không giải thích thêm
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2024
Môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(Đề số 4)
Cho biết nguyên tử khối của các nguyên tố: H = 1, C = 12, N = 14, O = 16, Na = 23, Mg = 24, Al = 27, P = 31, S = 32, Cl = 35,5, K = 39, Ca = 40, Fe = 56, Cu = 64, Zn = 65, Br = 80, Ag = 108, Ba = 137.
Phần I: Trắc nghiệm
Câu 1: Trộn lẫn 300ml dung dịch NaOH 0,001M vào 300ml dung dịch HCl 0,003M thu được dung dịch X có giá trị pH là?
A. 1. B. 2. C. 3. D. 4.
Câu 2: Hiện tượng quan sát được khi cho lượng dư CO2 vào dung dịch nước vôi trong là ?
A. Xuất hiện kết tủa trắng sau đó tan dần.
B. Xuất hiện kết tủa trắng không tan.
C. Không có hiện tượng gì.
D. Có bọt khí bay ra.
Câu 3: Chất nào sau đây không thể phản ứng với NH3 ?
A. CuO.
B. HCl.
C. NaOH.
D. Cl2.
Câu 4: Trong dung dịch X có chứa : 0,15 mol Ca2+, 0,3 mol Na+, x mol SO42- và y mol NO3-. Cô cạn dung dịch thu được 45,9 gam chất rắn. Giá trị x, y lần lượt là
A. 0,2 và 0,1.
B. 0,1 và 0,2.
C. 0,15 và 0,3.
D. 0,2 và 0,4.
Câu 5: Cho khí CO dư qua hỗn hợp FeO, CuO, MgO, Al2O3 . Sau phản ứng chất rắn thu được chứa ?
A. Fe, Cu, MgO, Al2O3.
B. FeO, CuO, Mg, Al2O3.
C. Fe, Cu, Mg, Al.
D. FeO, CuO, MgO, Al.
Câu 6: Cho các chất sau đây: HCl, NaOH, NaCl, C2H5OH, H3PO4, C6H6, H2O. Số chất điện ly mạnh là ?
A. 2. B. 3. C. 4. D. 5.
Câu 7: HNO3 có thể oxi hóa được chất nào sau đây ?
A. CuO.
B. FeO.
C. NaOH.
D. CaCO3.
Câu 8: Xét phương trình: NaOH + HCl → NaCl + H2O có phương trình thu gọn là
A. Na+ + Cl- → NaCl.
B. H+ + NaOH → Na+ + H2O.
C. H+ + OH- → H2O.
D. HCl + Na+ → NaCl + H+.
Câu 9: Khi nhiệt phân muối rắn nào sau đây sinh ra oxit kim loại ?
A. Hg(NO3)2.
B. Cu(NO3)2.
C. KNO3.
D. AgNO3.
Câu 10 : Hợp chất nào sau đây C có số oxi hóa là – 4 ?
A. CO.
B. CO2.
C. CH4.
D. Na2CO3.
Câu 11: Hấp thụ hoàn toàn 8,96(l) CO2 (đktc) vào 400ml dung dịch Ba(OH)2 1M thu được a(g) kết tủa. Giá trị của a là
A. 98,5.
B. 49,25.
C. 39,4.
D. 78,8.
Câu 12 : Phân ure có công thức hóa học là ?
A. (NH4)2CO3.
B. (NH2)2CO.
C. NH4NO3.
D. KNO3.
Câu 13: Nhiệt phân hoàn toàn m(g) muối Cu(NO3)2 một thời gian thấy khối lượng chất rắn giảm 1,08(g). Giá trị của m là
A. 1,88.
B. 1,89.
C. 1,80.
D. 1,08.
Câu 14: “Nước đá khô” là
A. CO rắn.
B. CO2 rắn.
C. N2 rắn.
D. NH4Cl.
Câu 15: Phát biểu nào sau đây là đúng ?
A. Photpho trắng tan trong nước không độc.
B. Photpho trắng được bao quản bằng cách ngâm trong nước.
C. Photpho trắng hoạt động hóa học kém hơn phopho đỏ.
D. Photpho đỏ phát quang màu lục nhạt trong bóng tối.
Câu 16: Chất nào sau đây có thể hòa tan CaCO3 ?
A. khí CO2 khô.
B. HCl.
C. NaOH.
D. K2CO3.
Câu 17: Khí nào sau đây được sinh ra khi có sấm chớp ?
A. NO.
B. CO2.
C. N2.
D. N2O.
Câu 18: Cho luồng khí CO dư qua 9,1g hỗn hợp CuO, MgO đến khi phản ứng hoàn toàn thu được 8,3g chất rắn. Khối lượng CuO có trong hỗn hợp là
A. 0,8g.
B. 2g.
C. 4g.
D. 1,6g.
Câu 19: Hai chất CH3COOH và CH2=CH-COOH giống nhau về ?
A. Công thức phân tử.
B. Công thức cấu tạo.
C. Loại nhóm chức.
D. Loại liên kết hóa học .
Câu 20: Cho các phát biểu sau đây:
1- Liên kết trong hợp chất hữu cơ chủ yếu là liên kết cộng hóa trị.
2- CuSO4 khan dùng để phát hiện nước lẫn trong hợp chất hữu cơ.
3- Hợp chất hữu cơ được chia làm 3 loại cơ bản : hiđrocabon, dẫn xuất hiđrocacbon, hợp chất có oxi.
4- Các chất hữu cơ thường kém bền nhiệt, dễ cháy.
Số phát biểu sai là
A. 1. B. 2. C. 3. D. 4.
Phần II: Tự luận
Câu 1: Hòa tan hoàn toàn 12,84g hỗn hợp Al, Cu vào lượng dư dung dịch HNO3 loãng, nóng thu được 4,928 (lít) NO là sản phẩm khử duy nhất ở điều kiện tiêu chuẩn và dung dịch X. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Câu 2: Đốt cháy hoàn toàn 6,15g chất hữu cơ X thu được 2,25g H2O; 6,72(l) CO2 và 0,56(l) N2 (đktc). Tính % khối lượng các chất trong X.
Đáp án & Hướng dẫn giải
Phần I: Trắc nghiệm
Câu 1: C
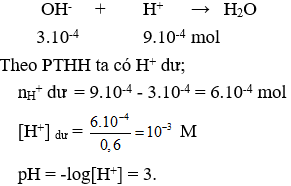
Câu 2. A
CO2 + Ca(OH)2 → CaCO3 (↓ trắng) + H2O
CO2 dư + H2O + CaCO3 (↓ trắng) → Ca(HCO3)2 dd
Câu 3. C
NH3 không thể phản ứng với NaOH.
Câu 4. C
Bảo toàn điện tích:
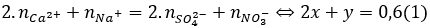
Bảo toàn khối lượng:
mmuối = ∑mion ↔ 96x + 62y = 45,9 – 0,15.40 – 0,3.23 = 33 (2)
Từ (1) và (2) có: x = 0,15 và y = 0,3.
Câu 5. A
CO chỉ khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại.
Vậy chất rắn thu được sau phản ứng là: Fe, Cu, MgO, Al2O3.
Câu 6. B
Chất điện li mạnh gồm axit mạnh, bazơ mạnh và hầu hết các muối.
→ Các chất điện li mạnh là: HCl, NaOH, NaCl.
Câu 7. B
Trong FeO, nguyên tố Fe chưa đạt số oxi hóa cao nhất nên FeO bị oxi hóa bởi HNO3.
Câu 8. C
Phương trình ion rút gọn là: H+ + OH- → H2O.
Câu 9. B
Muối nitrat của Mg, Zn, Fe, Pb, Cu … bị phân hủy tạo ra oxit kim loại tương ứng, NO2 và O2.
Câu 10. C
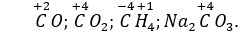
Câu 11. D
Ta có: 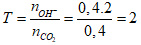
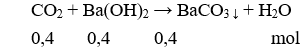
a = 0,4.197 = 78,8 gam.
Câu 12. B
Ure: (NH2)2CO.
Câu 13. A
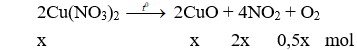
Khối lượng chất rắn giảm chính là khối lượng khí
→ 92x + 16x = 1,08 → x = 0,01 (mol)
m = 0,01.188 = 1,88 gam.
Câu 14. B
Nước đá khô là CO2 rắn.
Câu 15. B
A sai vì photpho trắng không tan trong nước, rất độc.
C sai vì photpho đỏ kém hoạt động hóa học hơn photpho trắng.
D sai vì photpho đỏ không phát quang trong bóng tối.
Câu 16. B
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
Câu 17. A
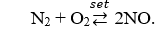
Câu 18. C
Cho CO qua hỗn hợp CuO và MgO chỉ có CuO phản ứng:
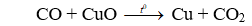
Khối lượng chất giảm chính là khối lượng O trong CuO.
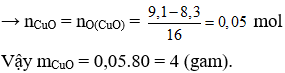
Câu 19. C
Hai chất đều có nhóm chức – COOH.
Câu 20. A
Phát biểu 3 sai vì hợp chất hữu cơ được chia thành 2 loại cơ bản là hiđrocabon và dẫn xuất hiđrocacbon.
Phần II: Tự luận
Câu 1.
Gọi số mol Al và Cu trong hỗn hợp lần lượt là x và y (mol)
mKL = 12,84 gam → 27x + 64y = 12,84 (1)
PTHH:
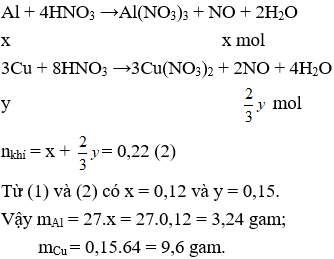
Câu 2.
Đốt cháy hoàn toàn X thu được H2O, CO2 và N2 nên X chứa C, H, N và có thể có O.
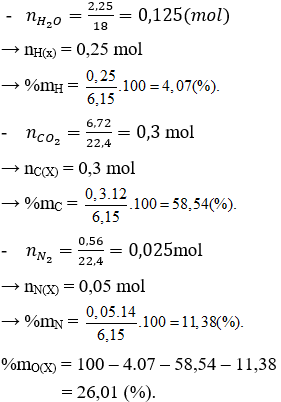

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2024
Môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(Đề số 5)
Cho biết nguyên tử khối của các nguyên tố: H = 1, C = 12, N = 14, O = 16, Na = 23, Mg = 24, Al = 27, P = 31, S = 32, Cl = 35,5, K = 39, Ca = 40; Fe = 56, Cu = 64, Zn = 65, Br = 80, Ag = 108, Ba = 137.
Phần I: Trắc nghiệm
Câu 1: Cho Cu tác dụng với dung dịch HNO3 loãng tạo ra khí A không màu hóa nâu ngoài không khí. Cho Fe tác dụng với dung dịch HNO3 thì tạo ra khí B có màu nâu đỏ. Khí A và B lần lượt là?
A. NO2 và NO.
B. NO và N2O.
C. N2 và NO.
D. NO và NO2.
Câu 2: Hiđrocacbon nào sau đây có tỉ khối so với H2 bằng 15 ?
A. C2H4.
B. C2H6.
C. HCHO.
D. C2H2.
Câu 3: Để nhận biết ion PO43- ta dùng thuốc thử nào sau đây ?
A. NaCl.
B. AgNO3.
C. K3PO4.
D. NaOH.
Câu 4: Cấu hình electron của N ( Z = 7 ) là ?
A. 1s22s22p3.
B. 1s22s22p5.
C. 1s22s22p4.
D. 1s22s22p6.
Câu 5: Nhiệt phân hoàn toàn AgNO3 thu được sản phẩm gồm ?
A. Ag, NO, O2.
B. Ag, NO2, O2.
C. Ag2O, NO, O2.
D. Ag2O, NO2, O2.
Câu 6 : Cho 3,84g Cu phản ứng với 80ml dung dịch chứa HNO3 1M và H2SO4 0,5M thấy thoát ra V(l) NO ở (đktc) là sản phẩm khử duy nhất. Tìm V ?
A. 0,448.
B. 0,896.
C. 1,792.
D. 1,344.
Câu 7: Theo thuyết arenius có bao nhiêu chất sau đây là bazơ : NaOH, KOH, HCl, HClO4, Al(OH)3?
A. 1. B. 2. C. 3. D. 4.
Câu 8 : Cho 200ml dung dịch KOH 0,3M tác dụng với 200ml dung dịch HCl 0,1M thu được dung dịch sau phản ứng có pH là ?
A. 12. B. 2. C. 13. D. 1.
Câu 9: Oxit nào sau đây không tạo muối ?
A. NO2.
B. CO2.
D. P2O5.
D. CO.
Câu 10: Oxit nào sau đây không bị khử bởi CO khi đun nóng ?
A. CuO.
B. MgO.
C. Fe2O3.
D. Fe3O4.
Câu 11: Để khắc chữ lên thủy tinh người ta ứng dụng phản ứng nào sau đây ?
A. SiO2 + 2Mg → 2MgO + Si.
B. SiO2 + 2NaOH → Na2SiO3 + H2O.
C. Si + 2NaOH + H2O → Na2SiO3 + 2H2.
D. SiO2 + 4HF → SiF4 + 2H2O.
Câu 12: Chất nào sau đây chỉ chứa liên kết đơn ?
A. C2H6.
B. C2H4.
C. C3H6.
D. C4H6.
Câu 13: Hợp chất nào sau đây C có số oxi hóa cao nhất?
A. Al4 C3.
B. CH4.
C. CO2.
D. CO.
Câu 14: Cho các phát biểu sau:
1/ Hằng số K = 10-14 là hằng số phân ly của nước ở 25°C.
2/ Phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi sản phẩm có đủ các điều kiện: có chất kết tủa, chất khí, chất điện ly yếu.
3/ Dung dịch NaCl có pH = 7.
4/ (NH4)2CO3 dùng làm thuốc đau dạ dày
5/ Ure có công thức (NH2)2CO.
Số phát biểu đúng là?
A. 2. B. 3. C. 4. D. 5.
Câu 15 : Để khử hoàn toàn 26g hỗn hợp gồm CuO, Fe2O3, MgO cần dùng 5,6 lít CO (đktc). Khối lượng chất rắn sau phản ứng là bao nhiêu ?
A. 22. B. 24. C. 26. D. 28.
Câu 16 : Sục 2,24(l) CO2 ở đktc vào 150ml NaOH 1M thu được dung dịch Y. Khối lượng muối có trong dung dịch Y là bao nhiêu gam ?
A. 4,2. B. 5,3. C. 9,5. D. 8,2.
Câu 17: Nhiệt phân hoàn toàn 18,8g Cu(NO3)2 thu được 12,32g chất rắn. Xác định hiệu suất của phản ứng nhiệt phân là ?
A. 40%.
B. 50%.
C. 60%.
D. 80%.
Câu 18: Dung dịch NH3 trong phenol phtalein có màu ?
A. Hồng.
B. Đỏ.
C. Xanh.
D. Không màu.
Câu 19 : Na2CO3 có tên gọi thông dụng là ?
A. Nabica.
B. Sođa.
C. Photgen.
D. Cacbonat.
Câu 20 : Hợp chất hữu cơ nhất thiết phải có ?
A. H.
B. C.
C. C,H,O.
D. C,H,O,N.
Phần II: Tự luận
Câu 1. Cho 12,27 gam Cu và Al tác dụng hoàn toàn dung dịch HNO3 đặc, nóng, dư thu được 16,8 lít khí NO2 ( đktc ) là sản phẩm khử duy nhất.
a. Viết phản ứng xảy ra.
b. Xác định % khối lượng kim loại trong hỗn hợp.
Câu 2. Đốt cháy hoàn toàn 8,8 gam một hợp chất hữu cơ X thu được 8,96 (l) CO2 (đktc) và 7,2 (g) H2O.
a. Xác định công thức đơn giản của X.
b. Tìm CTPT của X nếu biết MX = 88 ( g/mol).
Đáp án & Hướng dẫn giải
Phần I: Trắc nghiệm
Câu 1. D
A là khí không màu hóa nâu ngoài không khí → A là NO.
B là khí có màu nâu đỏ → B là NO2.
Câu 2. B
Hợp chất là hiđrocacbon → loại C.
Theo bài ra: M = 15.2 = 30.
Vậy hợp chất cần chọn là C2H6 (thỏa mãn là hiđrocacbon, M = 30).
Câu 3. B
3Ag+ + PO43- → Ag3PO4 (↓ vàng).
Câu 4. A
N (z = 7): 1s22s22p3.
Câu 5. B
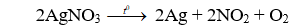
Câu 6. B
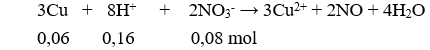
Theo PTHH có NO3- dư, Cu và H+ hết.
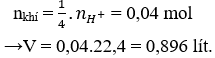
Câu 7. B
Theo thuyết arenius: NaOH; KOH là bazơ; HCl; HClO4 là axit; Al(OH)3 là hiđroxit lưỡng tính.
Câu 8. C
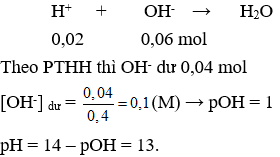
Câu 9. D
CO là oxit trung tính hay oxit không tạo muối.
Câu 10. B
CO chỉ khử được oxit của những kin loại đứng sau Al trong dãy hoạt động hóa học của kim loại → MgO không bị khử bới CO khi đun nóng.
Câu 11. D
Để khắc chữ lên thủy tinh ứng dụng phản ứng: SiO2 + 4HF → SiF4 + 2H2O.
Câu 12. A
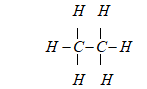
Câu 13. C
Trong CO2, nguyên tố C có số oxi hóa cao nhất (+4).
Câu 14. B
1/ đúng.
2/ chưa đúng: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion có thể kết hợp với nhau tạo thành ít nhất một trong các chất sau: chất kết tủa, chất điện ly yếu, chất khí.
3/ đúng.
4/ chưa đúng: NaHCO3 được dùng làm thuốc giảm đau dạ dày do thừa axit.
5/ đúng.
Câu 15. A
Hỗn hợp oxit + CO → hỗn hợp chất rắn + CO2.
Bảo toàn C có nCO2 = nCO = 0,25 mol.
Bảo toàn khối lượng có:
mhh ban đầu + mCO = mcr sau + mCO2 → mcr sau = 26 + 0,25.28 – 0,25.44 = 22 gam.
Câu 16. C
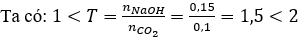
Vậy sau phản ứng thu được 2 muối: NaHCO3 (x mol) và Na2CO3 (y mol)
Bảo toàn Na có: x + 2y = 0,15 (1)
Bảo toàn C có: x + y = 0,1 (2)
Từ (1) và (2) có x = y = 0,05.
Khối lượng muối có trong Y là m = 0,05 (84 + 106) = 9,5 gam.
Câu 17. C
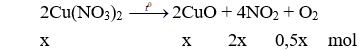
Bảo toàn khối lượng có:
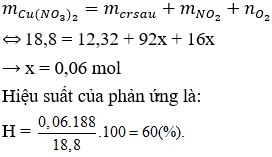
Câu 18. A
Dung dịch NH3 trong phenol phtalein có màu hồng do dung dịch NH3 có tính bazơ.
Câu 19. B
Na2CO3 có tên thông dụng là sođa.
Câu 20. B
Hợp chất hữu cơ nhất thiết phải có cacbon (C).
Phần II: Tự luận
Câu 1.

Câu 2.
a/ Đốt cháy X thu được CO2 và H2O → X chứa C, H và có thể có O.
Đặt công thức tổng quát của X là CxHyOz
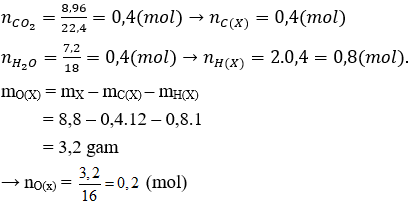
Có x : y : z = nC(X) : nH(X) : nO(X) = 0,4 : 0,8 : 0,2 = 2 : 4 : 1
Vậy công thức đơn giản nhất của X là C2H4O
b/ Công thức phân tử của X có dạng: (C2H4O)n
Có MX = 88 → 44n = 88 → n = 2.
Công thức phân tử của X là: C4H8O2.