Đề thi Hóa Học lớp 11 Giữa học kì 1 năm 2024 có ma trận (15 đề)
Đề thi Hóa Học lớp 11 Giữa học kì 1 năm 2024 có ma trận (15 đề)
Haylamdo biên soạn và sưu tầm Đề thi Hóa Học lớp 11 Giữa học kì 1 năm 2024 có ma trận (15 đề) được tổng hợp chọn lọc từ đề thi môn Hoá học 11 của các trường trên cả nước sẽ giúp học sinh có kế hoạch ôn luyện từ đó đạt điểm cao trong các bài thi Hoá học lớp 11.

Phần I. Ma trận đề thi giữa học kì 1 hóa 11
|
Nội dung kiến thức |
Mức độ nhận thức |
Cộng |
||||||||||||
Nhận biết |
Thông hiểu |
Vận dụng bậc thấp |
Vận dụng mức cao hơn |
|||||||||||
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
|||||||
|
1. Sự điện li |
- Phân biệt được chất điện li mạnh, chất điện li yếu. - Phân loại chất điện li mạnh yếu, viết phương trình điện li. |
- Vận dụng bảo toàn điện tích trong dd các chất điện li |
||||||||||||
Số câu hỏi |
2 |
2 |
||||||||||||
2. Axit - bazơ - muối |
Định nghĩa : axit, bazơ và muối theo thuyết A-rê-ni-ut. Nhận biết hiđroxit lưỡng tính. |
- Phân biệt các loại muối. - Tính nồng độ của dung dịch dung dịch muối khi biết khối lượng. |
||||||||||||
Số câu hỏi |
1 |
1 |
1 |
3 |
||||||||||
3. Sự điện li của nước, pH, chất chỉ thị axit - bazơ |
- Định nghĩa môi trường axit và môi trường kiềm dựa vào pH hoặc [H+] |
- Xác định được môi trường của dung dịch bằng cách sử dụng giấy quỳ tím hoặc pH hoặc [H+] |
- Tính nồng độ H+ dựa vào nồng độ OH- và tích số ion của nước. - Tính pH của dung dịch axit mạnh, bazơ mạnh. |
- Tính pH của dung dịch khi trộn axit mạnh, bazơ mạnh. - Tính pH và kết tủa. |
||||||||||
Số câu hỏi |
1 |
1 |
1 |
1 |
4 |
|||||||||
4. Phản ứng trao đổi ion trong dung dịch các chất điện li |
- Bản chất phản ứng trao đổi ion - Điều kiện xảy ra phản ứng trao đổi ion. |
- Viết được phương trình phân tử và ion rút gọn. - Xác định các cặp chất xảy ra phản ứng hoặc không xảy ra phản ứng. |
- Bài tập tổng hợp về phương trình ion rút gọn. - Các bài tập hiddroxit lưỡng tính, oxit axit pứ với dd kiềm, dd H+ pứ muối cacbonat |
|||||||||||
Số câu hỏi |
1 |
1 |
1 |
3 |
||||||||||
5. Nito- photpho |
- Nêu được cấu tạo nguyên tử, phân tử, tính chất vật lí, hóa học, trạng thái tự nhiên, điều chế, ứng dụng của nitơ và hợp chất của nito |
- Viết được ptpư thể hiện tchh của nitơ và các hợp chất của nitơ. - Nêu hiện tượng và giải thích. - Xác định được vai trò của các chất trong một phản ứng (oxi hóa khử) cụ thể. - Xác định các cặp chất có phản ứng với nhau được hay không. |
- Giải bài toán liên quan đến amoniac, muối amoni, muối nitrat. - Giải bài toán phản ứng của kim loại, oxit kim loại với dung dịch HNO3. - Tổng hợp lý thuyết về nitơ và các hợp chất của nitơ. |
- Giải quyết vấn đề thực tiễn, thực nghiệm có liên quan đến nitơ và hợp chất của nó. - Giải được bài toán liên quan đến phản ứng điều chế amoniac, bài toán KL với HNO3. |
||||||||||
2 |
1 |
2 |
1 |
4 |
1 |
1 |
1 |
13 |
||||||
Tổng |
7 |
1 |
5 |
3 |
4 |
2 |
1 |
2 |
25 |
|||||
PHẦN II. ĐỀ THI
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2024
Bài thi môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
Câu 1. Dung dịch nào sau đây có môi trường kiềm?
A. Dung dịch có [H+] = 10-11M.
B. Dung dịch có [H+] = 10-7M.
C. Dung dịch có [OH-] = 10-7M.
D. Dung dịch có [OH-] = 10-11M.
Câu 2. Hiđroxit nào sau đây là hiđroxit lưỡng tính?
A. Fe(OH)3.
B. Zn(OH)2.
C. KOH.
D. Ba(OH)2.
Câu 3. Trong số các chất sau: Cu(OH)2, Ba(NO3)2, HClO2, H2S, chất điện li mạnh là
A. HClO2.
B. H2S.
C. Ba(NO3)2.
D. Cu(OH)2.
Câu 4. Cặp chất nào sau đây vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH?
A. Zn(OH)2, NaHCO3.
B. Al(OH)3, NH4HSO4.
C. KAlO2, (NH4)2CO3.
D. NH4Cl, NaHS.
Câu 5: Khi thêm một ít dung dịch HCl vào dung dịch CH3COOH thì nồng độ ion CH3COO- trong dung dịch thu được sẽ thay đổi như thế nào so với dung dịch ban đầu?
A. Tăng.
B. Giảm.
C. Không đổi.
D. Tăng sau đó giảm.
Câu 6: Cho từ từ dung dịch KHSO4 vào lượng dư dung dịch Ca(HCO3)2 thì
A. có sủi bọt khí CO2, có kết tủa trắng CaSO4, trong dung dịch có K2CO3.
B. có sủi bọt khí CO2, có kết tủa trắng CaSO4 và CaCO3, trong dung dịch có KHCO3.
C. có sủi bọt khí CO2, có kết tủa trắng CaSO4, trong dung dịch có KHCO3.
D. có sủi bọt khí CO2, có kết tủa trắng CaSO4 và CaCO3, trong dung dịch có KHSO4.
Câu 7. Dung dịch nào sau đây không dẫn điện?
A. Dung dịch NaCl trong nước.
B. Dung dịch C2H5OH trong nước.
C. Dung dịch KCl trong nước.
D. Dung dịch H2SO4 trong nước.
Câu 8. Trị số pH của dung dịch HCl 0,0005M là
A. 2,4.
B. 3,1.
C. 1,68.
D. 3,3.
Câu 9. Dãy nào sau đây gồm các ion cùng tồn tại trong một dung dịch?
A. NH4+, Al3+, NO3-, Cl-.
B. K+, Ca2+, Cl-, CO32-.
C. K+, Na+, OH-, HCO3-.
D. Mg2+, PO43-, OH-, Ca2+.
Câu 10. Phản ứng nào sau đây có phương trình ion rút gọn là: S2- + 2H+ → H2S?
A. Na2S + 2HCl → 2NaCl + H2S.
B. Na2S + 2CH3COOH → 2CH3COONa + H2S.
C. FeS + 2HCl → FeCl2 + H2S.
D. FeS + H2SO4→ FeSO4 + H2S.
Câu 11. Dung dịch nào sau đây làm quỳ tím hóa đỏ?
A. Dung dịch có pH = 8.
B. Dung dịch có pH = 10.
C. Dung dịch có pH = 4.
D. Dung dịch có pH = 7.
Câu 12. Trong số các muối sau: KHSO4, CH3COONa, NH4Cl, Ca3(PO4)2, số muối axit là
A. 3.
B. 1.
C. 2.
D. 4.
Câu 13. Có 4 dung dịch: NaOH, NaCl, CH3COOH, Na2SO4 đều có nồng độ 0,1M. Dung dịch có tổng nồng độ mol của các ion nhỏ nhất là
A. NaCl.
B. NaOH.
C. CH3COOH.
D. Na2SO4.
Câu 14. NH3 thể hiện tính khử khi tác dụng với chất X và thể hiện tính bazơ khi tác dụng với chất Y. Các chất X, Y tương ứng là
A. O2, HCl.
B. HCl, O2.
C. H2O, ZnCl2.
D. ZnCl2, H2O.
Câu 15: Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là:
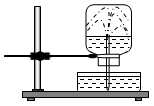
A. Nước phun vào bình và chuyển thành màu xanh.
B. Nước phun vào bình và chuyển thành màu hồng.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu tím.
Câu 16. Cho 4 dung dịch loãng, có cùng nồng độ mol: C2H5COOH, HCl, NH3, Ba(OH)2. Dung dịch có pH nhỏ nhất và lớn nhất lần lượt là
A. HCl và NH3.
B. CH3COOH và Ba(OH)2.
C. HCl và Ba(OH)2.
D. CH3COOH và NH3.
Câu 17: Trộn các cặp chất và dung dịch sau:
(1) NaHSO4 + NaHSO3;
(2) Na3PO4 + K2SO4;
(3) AgNO3 + Fe(NO3)2;
(4) CH3COONa + H2O;
(5) CuS + HNO3 (đ, t°);
(6) Ba(OH)2 + H3PO4;
(7) Ca(HCO3)2 + NaOH;
(8) NaOH + Al(OH)3;
(9) MgSO4 + HCl.
Số phản ứng axit - bazơ xảy ra là :
A. 4. B. 5.
C. 7. D. 6.
Câu 18. Một dung dịch không thể chứa đồng thời các ion nào sau đây:
A. Al3+, K+, H+, NO3-, SO42-.
B. Fe3+, Cu2+, Na+,NH4+,Cl-
C. Mg2+, Ca2+, H+, OH-, Cl-, SO42-.
D. NH4+., K+, Na+, PO43-, CO32-
Câu 19: Một dung dịch có chứa các ion: NH4+ (0,1 mol), K+ (0,15 mol), NO3- (0,1 mol), và CO32- (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Câu 20: Hòa tan hoàn toàn 13 gam Zn trong dung dịch HNO3loãng, dư thu được dung dịch X và 0,448 lít khí N2(đktc). Khối lượng muối trong dung dịch X là:
A. 37,8 gam B. 18,9 gam C. 28,35 gam D. 39,8 gam
Câu 21: Cho các phản ứng sau:
(1) (NH4)2SO4 + BaCl2 →
(2) CuSO4 + Ba(NO3)2 →
(3) Na2SO4 + BaCl2 →
(4) H2SO4 + BaSO3 →
(5) (NH4)2SO4 + Ba(OH)2 →
(6) Fe2(SO4)3 + Ba(NO3)2 →
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (1), (2), (3), (6).
B. (1), (3), (5), (6).
C. (2), (3), (4), (6).
D. (3), (4), (5), (6).
Câu 22. Phản ứng giữa HNO3 với P tạo khí NO. Tổng số các hệ số trong phản ứng là:
A. 17 B. 20 C. 18 D. 19
Câu 23. Thêm 0,15 mol NaOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng, trong dung dịch có các muối:
A. NaH2PO4 và Na2HPO4
B. NaH2PO4, Na2HPO4 và Na3PO4
C. Na2HPO4 và Na3PO4
D. NaH2PO4 và Na3PO4
Câu 24: Trong số các chất sau: C2H4; CH4; C6H6; Ca(HCO3)2, H2SO4, NaClO, Ba(OH)2, CuSO4, C2H5OH, CH3COOH, C6H12O6, CuO, CH3COONa, số chất điện li là
A. 7.
B. 8.
C. 6.
D. 5.
Câu 25: Cho 3,2 gam Cu tác dụng với 100 ml dung dịch gồm HNO30,8M và H2SO40,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là:
A. 0,448 B. 0,792 C. 0,672 D. 0,746
..........................
..........................
..........................
Tải xuống để xem đề thi Hóa học lớp 11 Giữa học kì 1 năm học 2023 đầy đủ!
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2024
Bài thi môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
Câu 1: Chất nào sau đây là chất điện li mạnh?
A. HNO2 B. HF C. Al2(SO4)3 D. CH3COOH
Câu 2: Chất nào sau đây là muối trung hòa?
A. Fe2(SO4)3 B. NaHCO3 C. KHSO4 D. NaH2PO4
Câu 3: Phát biểu nào sau đây đúng?
A. Khi tác dụng với kim loại hoạt động, N2 thể hiện tính khử.
B. Sấm chớp trong các trận mưa dông có thể tạo ra khí N2O do N2 tác dụng với O2.
C. Nitơ không duy trì sự hô hấp do nitơ là khí độc.
D. Vì phân tử N2 có liên kết ba rất bền nên ở nhiệt độ thường N2 khá trơ về mặt hóa học.
Câu 4: Dẫn khí NH3 vào nước thu được dung dịch có tính:
A. Bazo B. Axit C. Lưỡng tính D. Trung tính
Câu 5: Axit HNO3 đặc, nguội không tác dụng với kim loại nào sau đây?
A. Fe B. Cu C. Ag D. Zn
Câu 6: Số oxi hóa của N được xếp theo thứ tự tăng dần như sau :
A. N2 , NO , NH3 , NO2- , NO3-
B. NO , N2O , NH3 , NO3- , N2
C. NH3 , N2 , NH4+ , NO , NO2
D. NH3 , N2O , NO , NO2- , NO3-
Câu 7: Chọn câu phát biểu không đúng:
A. Phản ứng tổng hợp NH3 từ N2 và H2 là phản ứng thuận nghịch.
B. Nhỏ dung dịch NH3 đến dư vào dung dịch FeCl3thấy xuất hiện kết tủa màu nâu đỏ.
C. Nhiệt phân muối nitrat của kim loại luôn thu được kim loại và khí oxi.
D. Cho dd NaOH vào dung dịch CuSO4 thấy xuất hiện kết tủa màu xanh.
Câu 8: Phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi:
A. Tạo thành chất điện li yếu.
B. Có ít nhất một trong ba điều kiện trên
C. Tạo thành chất khí.
D. Tạo thành chất kết tủa.
Câu 9: Khối lượng kết tủa thu được khi trộn 10ml dung dịch Na2SO4 1M và 10 ml dung dịch BaCl2 1M là:
A. 1,79 gam B. 2,33 gam C. 3,94 gam D. 4,39 gam
Câu 10: Để tạo độ xốp cho một số loại bánh, trong bột nở thường dùng muối nào sau đây?
A. (NH4)2SO4. B. CaCO3. C. NH4NO2. D. NH4HCO3.
Câu 11: Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là kim loại, khí nitơ đioxit và oxi?
A. AgNO3. B. Mg(NO3)2. C. KNO3. D. NH4NO3.
Câu 12: Cho 40 ml dd HCl 0,75M vào 160 ml Ba(OH)2 0,1M. pH dung dịch thu được là:
A. 2,5. B. 0,96 C. 12. D. 1.
Câu 13: Trong 1,5 lít dung dịch có hòa tan 0,3 mol NaCl. Nồng độ mol/l của [Na+];[Cl-] lần lượt là:
A. 0,2M ; 0,2 M. B. 0,1M ; 0,2M.
C. 0,1M ; 0,1M. D. 0,3M ; 0,3M.
Câu 14: Cho sơ đồ điều chế HNO3 trong phòng thí nghiệm:
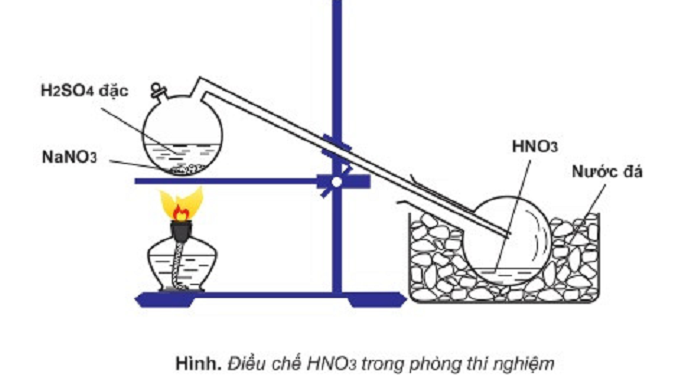
Phát biểu nào sau đây là sai khi nói về quá trình điều chế HNO3?
A. Đốt nóng bình cầu bằng đèn cồn để phản ứng xảy ra nhanh hơn.
B. HNO3 sinh ra dưới dạng hơi nên cần làm lạnh để ngưng tụ.
C. HNO3 là axit yếu hơn H2SO4 nên bị đẩy ra khỏi muối.
D. HNO3 có nhiệt độ sôi thấp (830C) nên dễ bị bay hơi khi đun nóng.
Câu 15: Chọn câu đúng
A. Giá trị pH tăng thì độ bazơ giảm
B. Dung dịch có pH >7 làm quỳ tím hoá xanh
C. Giá trị pH tăng thì độ axit tăng.
D. Dung dịch có pH >7 làm quỳ tím hoá đỏ.
Câu 16: Cho dd NaOH dư vào 300 ml dd NH4Cl 1,00 M, đun nóng nhẹ.Thể tích khí (đktc) thu được là:
A. 13,44 lít. B. 6,72 lít. C. 26,88 lít D. 3,36 lít.
Câu 17: Hòa tan 32 g hỗn hợp Cu và CuO trong dung dịch HNO31M (dư), thoát ra 6,72 lít khí NO (đktc). Khối lượng CuO trong hỗn hợp ban đầu là :
A. 2,52g. B. 1,88g. C. 3,2g D. 1,2g.
Câu 18: Phát biểu nào sau đây là khôngđúng?
A. Đốt cháy NH3 trong không khí (xúc tác Pt) tạo khí không màu hóa nâu ngoài không khí.
B. NH3 cháy trong oxi tỏa nhiều nhiệt nên được sử dụng là nhiên liệu tên lửa.
C. Nhỏ vài giọt dung dịch phenolphtalein vào dung dịch NH3 thấy dung dịch chuyển sang màu hồng
D. Cho dung dịch NH3 từ từ vào dung dịch AlCl3 thấy xuất hiện kết tủa trắng không tan trong NH3.
Câu 19: Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là oxit kim loại, khí nitơ đioxit và oxi?
A. Cu(NO3)2, AgNO3, NaNO3. B. KNO3, Hg(NO3)2, LiNO3.
C. Pb(NO3)2, Zn(NO3)2, Cu(NO3)2. D. Mg(NO3)2, Fe(NO3)3, AgNO3
Câu 20: Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch, lượng muối clorua khan thu được là:
A. 6,26 gam. B. 2,66 gam. C. 26,6 gam. D. 22,6 gam.
Câu 21: Cho 100ml dung dịch Ba(OH)2 nồng độ 0,1Mvào 1 lít dung dịch (NH4)2CO30,01M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch giảm là
A. 2,31 gam. B. 1,97 gam. C. 2,14 gam. D. 0,17 gam.
Câu 22: Cho dãy các chất: (NH4)2CO3, Al(OH)3, Zn(OH)2, NaHCO3, Na2SO4. Số chất trong dãy vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH là
A. 5. B. 4. C. 3. D. 2.
Câu 23: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,896 lít khí NO ở điều kiện tiêu chuẩn và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là
A. 8,88 gam. B. 13,32 gam.
C. 6,52 gam. D. 13,92 gam.
Câu 24: Nung một lượng xác định muối Cu(NO3)2. Sau một thời gian dừng lại để nguội rồi đem cân thấy khối lượng giảm 54 gam. Khối lượng Cu(NO3)2 đã bị phân hủy là :
A. 69 gam. B. 87 gam. C. 94 gam. D. 141 gam.
Câu 25: Dung dịch E chứa các ion Mg2+, SO42-, NH4+, Cl-. Chia dung dịch E ra 2 phần bằng nhau:
+ Phần I tác dụng với dung dịch NaOH dư, đun nóng, được 0,58 gam kết tủa và 0,672 lit khí (đktc).
+ Phần II tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa.
Tổng khối lượng các chất tan trong dung dịch E bằng
A. 3,055g. B. 6,11g. C. 5,35g. D. 9,165g.
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2024
Bài thi môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
Câu 1. Phương trình ion rút gọn của phản ứng cho biết
A. Nồng độ những ion nào trong dung dịch lớn nhất.
B. Những ion nào tồn tại trong dung dịch
C. Không tồn tại phân tử trong dung dịch các chất điện li.
D. Bản chất của phản ứng trong dung dịch các chất điện li.
Câu 2. Chất nào sau đây là chất điện li mạnh?
A. HF |
B. HNO2 |
C. Al2(SO4)3 |
D. CH3COOH |
Câu 3. Các ion nào sau đây không cùng tồn tại trong một dung dịch
A. Na+, NO3-, Mg2+, Cl- |
B. Fe3+, NO3- Mg2+, Cl- |
C. NH4+, OH-, Fe3+, Cl- |
D. H+, NH4+, SO42-, Cl- |
Câu 4. Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
A. MgCl2 |
B. NaOH |
C. C6H12O6 |
D. HClO |
Câu 5. Muối nào sau đây bền với nhiệt?
A. KClO3. |
B. NaCl. |
C. NaNO3. |
D. NH4HCO3. |
Câu 6. Số oxi hóa của nito trong các chất: NO2, N2O, HNO3, NH3 lần lượt là:
A. +4, +1,+5, -3 |
B. +4, +1,+5, +3 |
C. -4, +1,+5, -3 |
D. +4, -1,+5, -3 |
Câu 7. Hiện tượng xảy ra khi cho giấy quỳ khô vào bình đựng khí amoniac là
A. giấy quỳ chuyển sang màu đỏ.
B. giấy quỳ chuyển sang màu xanh.
C. giấy quỳ mất màu.
D. giấy quỳ không chuyển màu.
Câu 8. Axit nào dưới đây là axit 1 nấc
A. CH3COOH |
B. H3PO4 |
C. HClO4 |
D. H2SO4 |
Câu 9. Phương trình điện li nào dưới đây đúng?
A. H2SO4 →H+ + HSO4-
B. H2CO3 → H+ + HCO3-
C.H2SO3 → 2H++ SO32-
D. Na2S → 2Na++ S2−
Câu 10. Sục từ từ V lít NH3 (đktc) vào 200 ml dung dịch AlCl3 đến khi thu được 7,4 gam kết tủa. Giá trị của V.
A. 2,24 l |
B. 3,36 l |
C. 1,12 l |
D. 6,72 l |
Câu 11. Cho 40ml dung dịch HCl 0,75 M và 160 ml dung dịch Ba(OH)2 0,1M. pH dung dịch thu được là:
A. 2,5 |
B. 0,96 |
C.12 |
D. 1 |
Câu 12. Cho dung gồm dung dịch X gồm: 0,02 Na+, 0,04 mol Mg2+; 0,02 mol NO3-; x mol SO42-. Giá trị của x là
A. 0,04 mol |
B. 0,03 mol |
C. 0,02 mol |
D. 0,01 mol |
Câu 13. Bao nhiêu chất sau đây là muối axit: KHCO3, NaHSO4, Ca(HCO3)2, Na2HPO3, BaCl2, NaHS, K2HPO4
A. 4 |
B. 5 |
C. 7 |
D. 6 |
Câu 14. Dung dịch X có [H+] = 1.10-9 mol/l; môi trường của X là?
A. Lưỡng tính |
B. Trung tính |
C. Axit |
D. Bazo |
Câu 15. Phương trình ion rút gọn S2- + 2H+ → H2S
A. BaS + H2SO4 (loãng) → H2S + BaSO4
B. FeS (r) + 2HCl → 2H2S + FeCl2
C. H2 + S2 → H2S
D. Na2S + 2HCl → H2S + 2NaCl
Câu 16. Khử hoàn toàn 3,2 gam Fe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fe thu được sau phản ứng là bao nhiêu?
A. 3,36 gam |
B. 2,24 gam |
C. 4,46 gam |
D. 4,48 gam |
Câu 17. Cho dãy chất sau: Cr(OH)3, Al2(SO4)3, Mg(OH)2, Zn(OH)2, MgO, CrO3. Số chất trong dãy là chất lưỡng tính
A. 3 |
B. 2 |
C. 4 |
D. 1 |
Câu 18. Muối nào sau đây bền với nhiệt?
A. KClO3. |
B. NaCl. |
C. NaNO3. |
D. NH4HCO3. |
Câu 19. Cho các tính chất sau: 1) Hòa tan tốt trong nước, 2) Nặng hơn không khí, 3) Tác dụng với axit, 4) Làm xanh quỳ tím ẩm, 5) Khử được hiđro. Những tính chất của NH3 là:
A. 1, 4, 5. |
B. 1, 2, 3. |
C. 1, 3, 4. |
D. 2, 4, 5. |
Câu 20. Hòa tan hoàn toàn 13 gam kẽm trong dung dịch HNO3 dư thu được 1,12 lít khí X (đktc) là sản phẩm khử duy nhất. X là
A. NO. |
B. N2O. |
C. NO2. |
D. N2. |
Câu 21. Cho 1,86 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư, thu được 560ml khí N2O (đktc, sản phẩm khử duy nhất) bay ra. Khối lượng muối nitrat tạo ra trong dung dịch là
A. 40,5 gam |
B. 14,62 gam |
C, 24,16 gam |
D. 14,26 gam |
Câu 22. Khi bị nhiệt phân, dãy muối nitrat nào sau đây đều cho sản phẩm là oxit kim loại, khí nitơ đioxit và khí oxi?
A. Zn(NO3)2, KNO3, Pb(NO3)2.
B. Ca(NO3)2, LiNO3, KNO3.
C. Cu(NO3)2, Zn(NO3)2, Mg(NO3)2
D. Hg(NO3)2, AgNO3
Câu 23. Có 4 dung dịch không màu mất nhãn được đựng trong lọ riêng biệt: NH4Cl, (NH4)2SO4, BaCl2, Na2CO3 đựng trong 4 lọ mất nhãn riêng biệt. Dùng một dung dịch thuốc thử dưới đây để phân biệt 4 lọ trên.
A. NaCl |
B. NH3 |
C. NaNO3 |
D. Ba(OH)2 |
Câu 24: Tiến hành các thí nghiệm sau:
(1) Sục khí SO2 vào dung dịch H2S.
(2) Sục khí NH3 tới dư vào dung dịch AlCl3.
(3) Cho mẩu Na vào dung dịch CuSO4.
(4) Sục khí CO2 tới dư vào dd Ca(OH)2
(5) Cho dung dịch AgNO3 vào dung dịch NaCl.
(6) Sục khí H2S tới dư vào dd Pb(NO3)2
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
A. 3. B. 5. C. 4. D. 2.
Câu 25: Hòa tan hết hỗn hợp X gồm 5,6 gam Fe; 27 gam Fe(NO3)2 và m gam Al trong dung dịch chứa 0,61 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 47,455 gam muối trung hòa và 2,352 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16. Giá trị của m là
A. 1,080. B. 4,185. C. 5,400. D. 2,160

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2024
Bài thi môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
Câu 1: Một dung dịch có [H+] < [OH-] thì dung dịch đó có môi trường
A. axit.
B. bazơ.
C. trung tính.
D. không xác định được.
Câu 2: Phương trình điện li nào sau đây không đúng?
A. H2SO4 → 2H+ + SO42- .
B. CH3COOH ⇌ CH3COO- + H+ .
C. HF → H+ + F-.
D. KClO → K+ + ClO- .
Câu 3: Dung dịch nào sau đây không dẫn điện?
A. Dung dịch HCl trong nước.
B. Dung dịch glucozơ trong nước.
C. Dung dịch NaCl trong nước.
D. Dung dịch NaOH trong nước.
Câu 4: Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Axit axetic (CH3COOH) là axit nhiều nấc.
B. Một hợp chất trong thành phần phân tử có hiđro là axit.
C. Bazơ là chất khi tan trong nước phân li ra ion OH-.
D. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
Câu 5: Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, PO43-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3-.
D. K+, Al3+, Cl-, CO32-.
Câu 6: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. CaO + CO2 → CaCO3.
B. Fe + CuCl2 → FeCl2 + Cu.
C. Ba(NO3)2 + 2NaOH → Ba(OH)2 + 2NaNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Câu 7: Dung dịch gồm NaOH 0,2M và Ba(OH)2 0,1M có giá trị pH là
A. 13,6.
B. 0,4.
C. 0,5.
D. 13,5.
Câu 8: Chất X là muối khi tan trong nước tạo ra dung dịch có môi trường axit. Khi cho X tác dụng với dung dịch BaCl2 dư hay dung dịch KOH dư đều thu được kết tủa (sau khi phản ứng xảy ra hoàn toàn). X là
A. Al2(SO4)3.
B. ZnSO4.
C. Na2SO4.
D. CuSO4.
Câu 9: Trong dung dịch H3PO4 có tất cả bao nhiêu anion (bỏ qua sự phân li của nước)?
A. 1.
B. 2.
C. 3.
D. 4.
Câu 10: Muối nào sau đây là muối axit?
A. NH4HCO3.
B. HCOONa.
C. HCOONH4.
D. (NH4)2CO3.
Câu 11: Cho các chất sau: K2CO3; (NH4)2CO3; Al(OH)3; Fe(OH)2; Zn(OH)2; Ag; Cr(OH)3; Cu(OH)2; Al; Zn; CuS. Số chất tác dụng được với HCl là
A. 8.
B. 10.
C. 9.
D. 7.
Câu 12: Trong số các chất sau: HNO2, CH3COOH, C6H6, HCOOH, C6H12O6, C2H5OH, NaClO, CH4, NaOH, NH4NO3 , H2S. Số chất thuộc loại chất điện li yếu là
A. 7.
B. 5.
C. 6.
D. 4.
Câu 13: Cho các dung dịch có cùng nồng độ 0,01M: Ba(OH)2 (1); H2SO4 (2); NaOH (3); Na2SO4 (4). Thứ tự giảm dần giá trị pH của các dung dịch đó là
A. (2), (4), (3), (1).
B. (1), (3), (4), (2).
C. (1), (3), (2), (4).
D. (2), (3), (4), (1).
Câu 14: Xác định chất (A) và (B) trong chuỗi sau :
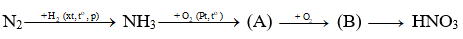
A. (A) là NO, (B) là N2O5 B. (A) là NO, (B) là NO2
C. (A) là N2, (B) là N2O5 D. (A) là N2, (B) là NO2
Câu 15: Cho các phản ứng hóa học sau:
(1) (NH4)2SO4 + BaCl2→ (2) CuSO4 + Ba(NO3)2→
(3) Na2SO4 + BaCl2→ (4) H2SO4 + BaSO3→
(5) (NH4)2SO4 + Ba(OH)2→ (6) Fe2(SO4)3 + Ba(NO3)2→
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (1), (2), (3), (6). B. (1), (3), (5), (6).
C. (2), (3), (4), (6). D. (3), (4), (5), (6).
Câu 16: Tiến hành các thí nghiệm sau:
(1) Sục khí SO2 vào dung dịch H2S.
(2) Sục khí NH3 tới dư vào dung dịch AlCl3.
(3) Cho mẩu Na vào dung dịch CuSO4.
(4) Sục khí CO2 tới dư vào dd Ca(OH)2
(5) Cho dung dịch AgNO3 vào dung dịch NaCl.
(6) Sục khí H2S tới dư vào dd Pb(NO3)2
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
A. 3. B. 5. C. 4. D. 2.
Câu 17: Hòa tan các chất sau: KOH, C2H5OH, C12H22O11, NaCl vào nước để thu được các dung dịch riêng rẽ. Trong các dung dịch thu được, có bao nhiêu dung dịch có khả năng dẫn điện?
A. 3 B. 2 C. 5 D. 6
Câu 18: Phương trình phản ứng nào dưới đây có phương trình ion rút gọn là:
H+ + OH- → H2O :
A. NH4Cl + NaOH→ NH3 + H2O + NaCl
B. Mg(OH)2 + 2HNO3→ Mg(NO3)2+ 2H2O
C. NaOH + HNO3 → NaNO3 + H2O
D. Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Câu 19: Cho 1,86 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư, thu được 560 ml lít khí N2O (đktc, sản phẩm khử duy nhất) bay ra. Khối lượng muối nitrat tạo ra trong dung dịch là
A. 40,5 gam. B. 14,62 gam.
C. 24,16 gam. D. 14,26 gam.
Câu 20: Có 4 dung dịch không màu: NH4Cl, (NH4)2SO4, BaCl2, Na2CO3 đựng trong 4 lọ mất nhãn riêng biệt. Dùng một dung dịch thuốc thử dưới đây để phân biệt 4 lọ trên
A. NaCl. B. NH3. C. NaNO3. D. Ba(OH)2.
Câu 21: Dãy các chất đều tác dụng với dung dịch Ba(OH)2 là:
A. NaHCO3, Na2CO3, CO2, MgSO4 , HCl
B. Mg(NO3)2, HCl, BaCl2, NaHCO3, Na2CO3
C. NaHCO3, Na2CO3, CO2, Mg(NO3)2, Ba(NO3)2
D. Ba(NO3)2, Mg(NO3)2, HCl, CO2, Na2CO3.
Câu 22: Cho V lít (đktc) hỗn hợp N2 và H2 có tỷ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng được 1,5 mol NH3. Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít B. 268,8 lít C. 336 lít D. 448 lít
Câu 23: Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 0,5M và HNO3 0,5M vào 100 ml dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M, thu được V lít khí CO2 (ở đktc). Giá trị của V là
A. 1,12.
B. 2,24.
C. 3,36.
D. 4,48.
Câu 24: Dung dịch X gồm 0,15 mol K+; 0,3 mol Mg2+; 0,25 mol Na+; a mol Cl- và b mol SO42-. Cô cạn dung dịch X thu được 61,8 gam muối khan. Giá trị của b là
A. 0,4.
B. 0,3.
C. 0,2.
D. 0,5.
Câu 25: Nung 2,23 gam hỗn hợp X gồm các kim loại Fe, Al, Zn, Mg trong oxi, sau một thời gian thu được 2,71 gam hỗn hợp Y. Hoà tan hoàn toàn Y vào dung dịch HNO3(dư), thu được 0,672 lít khí NO (sản phẩm khử duy nhất, ở đktc). Số mol HNO3 đã phản ứng
A. 0,12. B. 0,14. C. 0,16. D. 0,18.
