Bài tập đốt cháy hidrocacbon chọn lọc, có đáp án
Bài tập đốt cháy hidrocacbon chọn lọc, có đáp án
Tổng hợp 10 bài tập trắc nghiệm về Đốt cháy hidrocacbon môn Hóa học lớp 9 chọn lọc, có lời giải chi tiết đầy đủ câu hỏi lý thuyết và các dạng bài tập sẽ giúp học sinh có thêm bài tập tự luyện từ đó học tốt môn Hóa học lớp 9 hơn.

Bài 1: Đốt cháy hoàn toàn 1,68 g một hiđrocacbon X có M = 84 đvc cho ta 5,28g CO2. Số nguyên tử C trong phân tử X là:
A. 4 B. 5 C. 6 D. 7
Bài 2: Đốt cháy hoàn toàn 0,1 mol CxH4 rồi hấp thu hoàn toàn sản phẩm tạo ra vào 200ml dung dịch Ba(OH)2 1M thì thu được 19,7 gam kết tủa. Công thức của hiđrôcacbon là:
A. C3H4 B. CH4 hoặc C3H4 C. CH4 hoặc C2H4 D. C2H4
Bài 3: Đốt cháy hoàn toàn hỗn hợp X gồm hidrocacbon Y và khí CO thu được số mol CO2 bằng số mol nước. Y là:
A. C3H8 B. C3H6 C. C3H4 D. C4H8
Bài 4: Đốt 10cm3 một hidrocacbon bằng 80cm3 oxi (lấy dư). Sản phẩm thu được sau khi cho H2O ngưng tụ còn 65cm3 trong đó 25cm3 là oxi. Các thể tích đều đo ở đktc. Xác định công thức phân tử của hidrocacbon.
A. C4H10 B. C4H6 C. C5H10 D. C3H8
Bài 5: Đốt cháy một hidrocacbon X mạch hở, khí, với 1,92 gam khí oxi trong bình kín rồi cho các sản phẩm sau phản ứng qua bình một chứa trong H2SO4 đặc dư, bình hai chứa 3,5 lit Ca(OH)2 0,01M thu được 3g kết tủa, khí duy nhất bay ra có thể tích 0,224 lit đo ở 27,3oC và 1,1 atm. Xác định công thức phân tử của X, giả thiết các phản ứng xảy ra hoàn toàn.
A. C2H2 B. C3H8
C. C3H8 hoặc C2H2 D. C3H8 hoặc C2H2 hoặc CH4
Bài 6: Đốt cháy hoàn toàn hiđrocacbon X thu được số mol CO2 bằng một nửa số mol H2O. X có CTPT là
A. CH4 B. C2H6 C. C2H4 D. C3H8
Bài 7: Trộn 200 cm3 hỗn hợp chất hữu cơ X với 900 cm3 oxi dư rồi đốt. Thể tích hỗn hợp sau khi đốt là 1,2 lit. Sau khi làm ngưng tụ hơi nước còn lại 0,8 lit, tiếp tục cho đi qua dung dịch NaOH dư thì còn lại 0,4 lit (các thể tích ở cùng điều kiện). Công thức phân tử của X là:
A. C2H6 B. C2H4 C. C3H6 D. C3H8
Bài 8: Đốt cháy hoàn toàn a gam hỗn hợp X gồm CH4 và C3H6 và C4H 10 thu được 26,4 gam CO2 và 16,2 gam H2O. Hỏi a có giá trị là bao nhiêu
A. 6 gam B. 7,5 gam C. 8 gam D. 9 gam
Bài 9: Đốt cháy hoàn toàn hỗn hợp 2 hidrocacbon cùng thuộc dãy đồng đẳng thu được 7,84 lít CO2 (đktc) và 11,7 gam H2O . Hai hidrocacbon đó thuộc dãy đồng đẳng nào sau đây :
A. Anken B. Ankan C. Ankin D. Đáp án khác
Bài 10: Đốt cháy hoàn toàn 5,6 lít hỗn hợp hai ankan ( đktc) thu được 8,1 gam H2O . Dẫn hết sản phẩm vào dd Ca(OH)2 dư thì thu được kết tủa là :
A. 10 gam B. 15 gam C. 20 gam D. 25 gam
Đáp án và hướng dẫn giải
| 1. C | 2. B | 3. C | 4. B | 5. C |
| 6. A | 7. B | 8. D | 9. C | 10. C |
Bài 1:
nX = 1,68/84 = 0,02 mol
nCO2 = 5,28/44 = 0,12 mol ⇒ nC = 0,12 mol
Gọi x là số nguyên tử C trong phân tử X, ta có:
x = nC/nX = 0,12/0,02 = 6 (nguyên tử C)
⇒ Chọn C.
Bài 3:
Đốt cháy CxHy và CO thu được số mol CO2 bằng số mol H2O.
Gọi số mol của CxHy và CO lần lượt là a và b.
Theo định luật bảo toàn nguyên tố ta có:
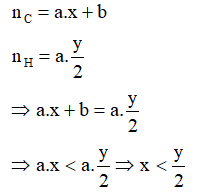
Vậy khi đốt cháy hidrocacbon CxHy có nCO2< nH2O.
Vậy hợp chất hidrocacbon là ankan, suy ra CTTQ là CnH2n+2.
⇒ Chọn A.
Bài 4:
VCO2 = 65-25 = 40 cm3
⇒ VO/H2O = VO/O2(bđ) - VO/CO2 - VO/O2(dư) = 80.2-40.2-25.2 = 30cm3
Gọi hidrocacbon là CxHy, ta có:
x = VCO2/10 = 40/10 = 4
y = 2VH2O/10 = 2.30/10 = 6
Vậy Hidrocacbon có CT là C4H6.
Bài 6:
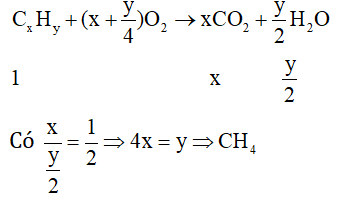
⇒ Chọn A.
Bài 7: Tương tự bài 4.
⇒ Chọn B.
Bài 8:
Ta biết hỗn hợp X chỉ gồm các hidrocacbon có nguyên tố C và H.
Quy đổi hỗn hợp X gồm C và H.
Khi đó ta có: mX = mC + mH
nCO2 = 26,4/44 = 0,6 mol ⇒ nC = 0,6 mol ⇒ mC = 0,6.12 = 7,2g
nH2O = 16,2/18 = 0,9 mol ⇒ nC = 0,9.2 = 1,8 mol ⇒ mH = 1,8g
⇒mX = mC + mH = 7,2+1,8 = 9g
⇒ Chọn D.
Bài 9:
nCO2 = 7,84/22,4 = 0,35 mol
nH2O = 11,7/18 = 0,65 mol
⇒ nCO2 < nH2O ⇒ ankan
⇒ Chọn B.
Bài 10:
nankan = 5,6/22,4 = 0,25 mol
nH2O = 8,1/18 = 0,45 mol
Vì ankan có CTTQ là CnH2n+2 nên ta có:
nH2O - nCO2 = nankan ⇒ nCO2 = 0,45 - 0,25 = 0,2 mol
Vì CO2 tác dụng với Ca(OH)2 dư nên tạo kết tủa hoàn toàn.
⇒ n↓ = nCO2 = 0,2 mol
⇒ m↓ = 0,2.100 = 20g
⇒ Chọn C.

