Bài tập Lập công thức phân tử hợp chất hữu cơ chọn lọc, có đáp án
Bài tập Lập công thức phân tử hợp chất hữu cơ chọn lọc, có đáp án
Tổng hợp 10 bài tập trắc nghiệm về Lập công thức phân tử hợp chất hữu cơ môn Hóa học lớp 9 chọn lọc, có lời giải chi tiết đầy đủ câu hỏi lý thuyết và các dạng bài tập sẽ giúp học sinh có thêm bài tập tự luyện từ đó học tốt môn Hóa học lớp 9 hơn.

Bài 1: Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam CO2 và 5,4 gam H2O. Ở đktc 2,24 lít khí A có khối lượng 3 gam. Xác định CTPT của A?
A. C2H6 B. C2H4 C. C3H8. D. C3H6
Bài 2: X mạch hở có công thức C3Hy. Một bình có dung tích không đổi chứa hỗn hợp khí X và O2 dư ở 150ºC, áp suất 2 atm. Bật tia lửa điện để đốt cháy X sau đó đưa bình về 150ºC, áp suất vẫn là 2 atm. Công thức phân tử của X?
A. C3H6 B. C3H4
C. C3H8 D. Không có đáp án
Bài 3: Khi đốt cháy hoàn toàn 15 mg chất A chỉ thu được khí CO2 và hơi nước, tổng thể tích của chúng quy về đktc là 22,4 ml. CTĐGN của A?
A. CH4O2 B. CH2O C. CH4 D. C2H4O
Bài 4: Khi đốt cháy 1 lít khí X cần 6 lít O2 thu được 4 lít CO2 và 5 lít H2O ( các khí đo cùng điều kiện ). CTPT của X là?
A. C4H10 B. C5H10O C. C4H10O D. C4H8O
Bài 5: Tìm công thức phân tử của 1 hiđrocacbon mà sau khi đốt cháy thu được 2,703 gam CO2 và 1,108 gam H2O ?
A. C2H4 B. C2H6 C. C5H12 D. C4H10
Bài 6: Đốt cháy hoàn toàn 0,58 gam một hyđrocacbon A được 1,76 gam CO2 và 0,9 gam H2O. Biết A có khối lượng riêng DA ≈2,59 gam/lít. Tìm CTPT A
A. C4H8 B. C5H10 C. C5H12 D. C4H10
Bài 7: Đốt cháy hoàn toàn 4,6 gam chất hữu có A thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. dA/kk = 1,58. Xác định CTPT của A?
A. C2H4O B. C2H6O C. C3H8O D. C4H10O
Bài 8: Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam CO2 và 5,4 gam H2O. Xác định CTPT của A biết 25 < MA < 35?
A. C2H6 B. C2H6O C. C2H4O D. C2H4
Bài 9: Đốt cháy hoàn toàn hợp chất hữu cơ A cần dung 6,72 lít O2 (đktc). Sau khi kết thúc thu được 13,2 gam CO2 và 5,4 gam H2O. Xác định CTPT của A biết dA/He = 15
A. C2H4O B. C2H4O2 C. C2H4 D. C4H8O
Bài 10: Đốt cháy hoàn toàn 18 gam hợp chất hữu cơ A cần vừa đủ 16,8 lít O2 (đktc). Hỗn hợp sản phẩm cháy gồm CO2 và H2O theo tỉ lệ thể tích VCO2:VH2=3:2. Xác định CTPT của A biết dA/H2 = 36
A. C3H8O B. C3H4 C. C3H4O D. C3H4O2
Đáp án và hướng dẫn giải
| 1. A | 2. B | 3. B | 4. C | 5. A |
| 6. D | 7. B | 8. A | 9. B | 10. D |
Bài 1:
nO2 = 11,2/32 = 0,35 mol
nCO2 = 8,8/44 = 0,2 mol ⇒ nC = 0,2 mol
nH2O = 5,4/18 = 0,3 mol ⇒ nH = 2.0,3 = 0,6 mol
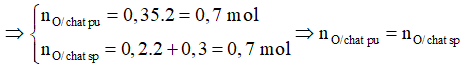
Vậy hợp chất hữu cơ A chỉ có C và H.
Gọi CTTQ của A là CxHy, khi đó ta có:
Vậy CTĐGN của A là (CH3)n.
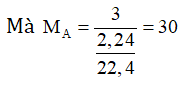
⇒ n = 30/15 = 2
Vậy A là C2H6.
⇒ Chọn A.
Bài 2:
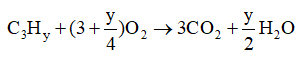
Vì P, V và T không đổi nên n↑ trước pư = n↑ sau pư.
Giả sử có 1 mol X phản ứng, vậy sẽ tạo ra 3 mol CO2 và y/2 mol H2O.
⇒ 1 + 3 + y/4 = 3 + y/2 ⇔ y = 4
Vậy X có công thức phân tử là C3H4.
⇒ Chọn B.
Bài 3:
Đặt CTTQ của A là CxHyOz
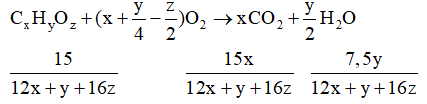
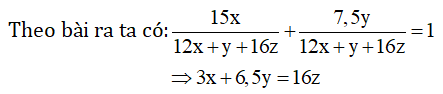
Vậy x = 1, y = 2, z = 1.
Vậy CTĐGN là CH2O.
⇒ Chọn B.
Bài 4:
Ta có tỉ lệ thể tích bằng tỉ lệ số mol.
VCO2 = 4 lit ⇒ VC = 4 lit
VH2O = 5 lit ⇒ VH = 2.5 = 10 lit
VO/O2 = 6.2 = 12 lit
vO/chất sp = 4.2 + 5 = 13 lit
VO/O2 < VO/chất sp
Suy ra trong X có C, H và O.
⇒ VO/X = 13-12 = 1 lit
Gọi CTTQ của X là CxHyOz, ta có:
x = VC/VX = 4/1 = 1
y = VH/VX = 10/1 = 10
z = VO/VX = 1/1 = 1
Vậy X có công thức là C4H10O.
⇒ Chọn C.
Bài 5: Tương tự bài 1.
⇒ Chọn A.
Bài 6:
Tương tự bài 1, ta tìm được CTĐGN của hidrocacbon là (C2H5)n.
Mà DA = 2,59 g/l ⇒ MA = 2,59.22,4 = 58g
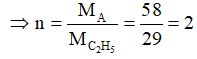
Vậy CTPT của A là C4H10.
⇒ Chọn D.
Bài 7:
nCO2 = 4,48/22,4 = 0,1 mol ⇒ nC = 0,2 mol mC = 2,4 g
nH2O = 5,4/18 = 0,3 mol ⇒ nH = 0,3.2 = 0,6 mol mH = 0,6g
⇒ mO =4,6 - 2,4 - 0,6 = 1,6g ⇒ nO/A = 1,6/16 = 0,1 mol
Vậy A gồm C, H và O.
Gọi CTTQ của A là CxHyOz, ta có:
Vậy CTĐGN của A là (C2H6O)n.
dA/kk = 1,58 ⇒ MA = 1,58.29 = 46g
⇒ n = 1
Vậy công thức phân tử của A là C2H6O.
⇒ Chọn B.
Bài 8: Tương tự bài 1.
⇒ Chọn A.
Bài 9: Tương tự bài 1.
⇒ Chọn B.
Bài 10:
Theo định luật bảo toàn khối lượng ta có:
mA + mO2 = mCO2 + mH2O
⇒ mCO2 + mH2O = 18 + 16,8/22,4 . 32 = 42g
Vì VCO2:VH2O = 3:2 nên nCO2:nH2O = 3:2
Gọi số mol của H2O và CO2 lần lượt là 2x và 3x, ta có:
2x.18 + 3x.44 = 42
⇒ x = 0,25
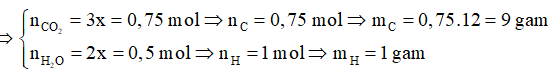
⇒ mO = 18-9-1=8g
⇒ nO/A = 8/16 = 0,5 mol
Vậy A gồm C, H và O.
Gọi CTTQ của A là CxHyOz, ta có:
x:y:z=nC:nH:nO = 0,75:1:0,5=3:4:2
Vậy CTĐGN của A là (C3H4O2)n.
Mà dA/H2 = 36 ⇒ MA = 72 ⇒ n=1
Vậy CTPT của A là C3H4O2.
⇒ Chọn D.

