Giải vở bài tập Hóa 8 Bài 27: Điều chế oxi - Phản ứng phân hủy
Giải vở bài tập Hóa lớp 8 Bài 27: Điều chế oxi - Phản ứng phân hủy
Nhằm mục đích giúp học sinh dễ dàng làm bài tập về nhà trong Vở bài tập Hóa lớp 8, chúng tôi biên soạn giải vở bài tập Hóa lớp 8 Bài 27: Điều chế oxi - Phản ứng phân hủy hay nhất, ngắn gọn bám sát nội dung sách Vở bài tập Hóa 8.
A - Học theo SGK
1. Lý thuyết
I. Điều chế oxi trong phòng thí nghiệm
1. Thí nghiệm
a) Thí nghiệm đun nóng KMnO4:
Hiện tượng: KMnO4 phân hủy sinh ra luồng khí làm cháy tàn đóm đỏ
Giải thích: Vì KMnO4 phân hủy sinh ra khí oxi, oxi làm tàn đóm cháy
b) Thí nghiệm đun nóng KClO3
Hiện tượng: đung nóng KClO3 thấy khí oxi thoát ra
Khi thêm bột MnO2: phản ứng xảy ra nhanh hơn
Hai cách thu khí oxi:
+) Đẩy không khí
+) Đẩy nước
2. Kết luận
Điều chế oxi trong phòng thí nghiệm bằng cách: đun nóng những hợp chất giàu oxi và kém bền với nhiệt.
II. Sản xuất khí oxi trong công nghiệp
Nguyên liệu: không khí hoặc nước
1. Sản xuất khí oxi từ không khí
Hóa lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lỏng bay hơi. Ở -1960C thu được khí nitơ sau đó ở -1830C thu được oxi
2. Sản xuất khí oxi từ nước
Điện phân nước trong bình điện phân sẽ thu được hai khí riêng biệt
III. Phản ứng phân hủy
| Phản ứng hóa học | Số chất phản ứng | Số chất sản phẩm |
|---|---|---|
| 2KClO3 →2KCl +3O2 ↑ | 1 | 2 |
| 2KMnO4 → K2MnO4 + MnO2 + O2↑ | 1 | 3 |
| CaCO3 → CaO+ CO2↑ | 1 | 3 |
2. Định nghĩa: Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới
2. Bài tập
1. Trang 99 Vở bài tập Hóa học 8 : Những chất nào trong số những chất sau được dùng để điều chế oxi trong phòng thí nghiệm :
a) Fe3O4 ;
b) KClO3 ;
c) KMnO4 ;
d) CaCO3 ;
e) Không khí;
g) H2O.
Lời giải
Những chất được dùng để điều chế oxi trong phòng thí nghiệm : b) KClO3 ; c) KMnO4 .
2. Trang 99 Vở bài tập Hóa học 8 : Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp ? Dẫn ra hai thí dụ để minh họa.
Lời giải
| Điều chế oxi | Phòng thí nghiệm | Công nghiệp |
|---|---|---|
| Nguyên liệu | KMnO4, KClO3 | Khồn khí, nước |
| Sản lượng | Đủ để làm thí nghiệm | Sản lượng lớn |
| Giá thành | Cao | Thấp |
3. Trang 99 Vở bài tập Hóa học 8 : Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp ? Dẫn ra hai thí dụ để minh họa.
Lời giải
| Phản ứng hóa hợp | Phản ứng phân hủy | |
|---|---|---|
| Chất tham gia | Hai hay nhiều chất | Một chất |
| Chất tạo thành | Một chất | Hai hay nhiều chất |
| Ví dụ | S + O2 →SO2 | CaCO3 → CaO+ CO2↑ |
4. Trang 99 Vở bài tập Hóa học 8 Tính số gam Kali clorat cần thiết để điều chế được :
a) 48 g khí oxi ;
b) 44,8 lít khí oxi (đktc).
Lời giải
a) Phương trình phản ứng: 2KClO3 →2KCl +3O2 ↑
Số mol khí oxi cần điều chế: nO2 = 48/32 = 1,5 mol
Theo phương trình phản ứng, cứ 3 mol O2 cần 2 mol KClO3
Số mol KClO3: nKClO3 = 2/3.1,5 = 1 mol; Số gam KClO3: mKClO3 = 1.122,5=122,5g
b) Số mol khí oxi cần điều chế: nO2 = (44,8)/(22,4)= 2 mol
Theo phương trình phản ứng, cứ 3 mol O2 cần 2 mol KClO3
Số mol KClO3: nKClO3 = 2/3.2 = 1,333 mol;
Số gam KClO3: mKClO3 = 1,333.122,5=162,3g
5. Trang 100 Vở bài tập Hóa học 8 : Nung đá vôi CaCO3 được vôi sống CaO và khí cacbonic CO2.
a) Viết phương trình hóa học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hóa học nào ? Vì sao ?
Lời giải
a) Phương trình hóa học: CaCO3 → CaO+ CO2↑
b) Phản ứng nung vôi thuộc phản ứng phân hủy. Vì dưới tác động của nhiệt độ, từ một chất (đá vôi) bị phân hủy thành hai chất (vôi sống và khí cacbonic).
6. Trang 100 Vở bài tập Hóa học 8 : Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxit sắt từ ?
b) Tính số gam kali penmanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
Lời giải
Phương trình hóa học: 3Fe + 2O2 → Fe3O4
a) Số mol Fe3O4: nFe3O4 = (2,32)/((56.3+16.4))= 0,01 mol
Theo phương trình hóa học: Để điều chế 1mol Fe3O4 cần 3 mol Fe và 2 mol O2
Số mol sắt: nFe = 0,03 mol; Số gam sắt: mFe = 0,03.56 = 1,68 g
Số mol oxi: nO2 = 0,02 mol; Số gam oxi: mO2 = 32.0,02 = 0,64 g
b) 1 mol O2 cần 2 mol KMnO4
0,02 mol O2 cần x mol KMnO4
→ x = 0,04 mol
Số gam KMnO4 cần dùng là: 0,04.158 = 6,32g
B - Giải bài tập
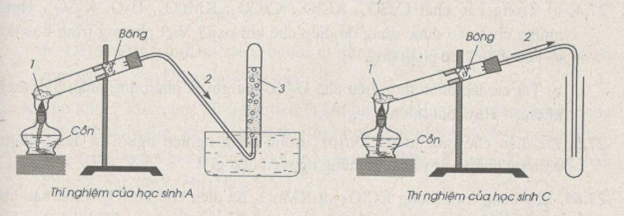
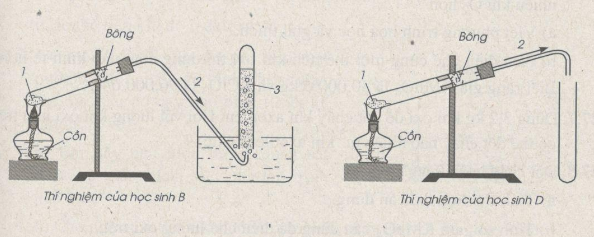
27.2. Trang 100 Vở bài tập Hóa học 8 : Trong bài thực hành thu khí oxi vào ống nghiệm bằng cách đẩy nước và đẩy không khí, có 4 học sinh A, B, C, D đã lắp ráp dụng cụ thí nghiệm như dưới đây. Hãy cho biết học sinh nào đã lắp ráp đúng. Lắp ráp không đúng. Giải thích. Xác định công thức các chất 1, 2, 3 có trong hình vẽ của các thí nghiệm.
Lời giải
Chất 1 có thể là : KMnO4, KClO3, KNO3 …, chất 2 : khí oxi; chất 3 : nước.
Học sinh A lắp ráp đúng ; học sinh B lắp ráp không đúng vì ống dẫn khí không đi vào ống nghiệm đựng nước do đó oxi bị mất một phần.
Học sinh C đã lắp ráp đúng ; học sinh D đã lắp ráp không đúng vì ống dẫn khí oxi không đi vào ống nghiệm, dẫn đến sự mất mát khí oxi.
27.3. Trang 101 Vở bài tập Hóa học 8 : Trong công nghiệp, oxi được điều chế bằng phương pháp điện phân nước (có pha axit sunfuric), thu được 2 chất khí riêng biệt là oxi và hiđro. Phương trình điện phân nước được biểu diễn như sau :
2H2O ⟶ 2H2 + O2
Điền những số liệu thích hợp vào những chỗ trống trong bảng dưới đây:
| H2O đã dùng | H2 tạo thành | O2 tạo thành | |
|---|---|---|---|
| a) | 2 mol | ....mol | ....mol |
| b) | ....mol | ........g | 16g |
| c) | ....mol | 10g | ....g |
| d) | 45g | .......g | ....g |
| e) | .......g | 8,96lít | ....lít |
| f) | 66,6ml | .......g | ....lít |
Lời giải
| H2O đã dùng | H2 tạo thành | O2 tạo thành | |
|---|---|---|---|
| a) | 2 mol | 2 mol | 1 mol |
| b) | 1 mol | 2 g | 16g |
| c) | 5 mol | 10 g | 80 g |
| d) | 45 g | 5 g | 40 g |
| e) | 7,2 g | 8,96 lít | 4,48 lít |
| f) | 66,6 ml | 7,4 g | 4,48 lít |
27.9. Trang 101 Vở bài tập Hóa học 8 : người ta điều chế vôi sống (CaO) bằng cách nung đá vôi (CaCO3). Lượng vôi sống thu được từ 1 tấn đá vôi có chứa 10% tạp chất là
A. 0,252 tấn.
B. 0,378 tấn.
C. 0,504 tấn.
D. 0,606 tấn.
(Biết hiệu suất phản ứng là 100%).
Lời giải
Chọn C
Khối lượng CaCO3 trong 1 tấn đá vôi là 1×90100=0,91×90100=0,9 (tấn)
Phương trình nhiệt phân
CaCO3⟶ CaO + CO2↑
100 tấn → 56 tấn
100 tấn → 56 tấn
x= 0,9.56/100 = 0,504


