Giải vở bài tập Hóa 8 Bài 33: Điều chế hiđro - Phản ứng thế
Giải vở bài tập Hóa lớp 8 Bài 33: Điều chế hiđro - Phản ứng thế
Nhằm mục đích giúp học sinh dễ dàng làm bài tập về nhà trong Vở bài tập Hóa lớp 8, chúng tôi biên soạn giải vở bài tập Hóa lớp 8 Bài 33: Điều chế hiđro - Phản ứng thế hay nhất, ngắn gọn bám sát nội dung sách Vở bài tập Hóa 8.
A - Học theo SGK
1. Lý thuyết
I. Điều chế khí hiđro
1. Trong phòng thí nghiệm :
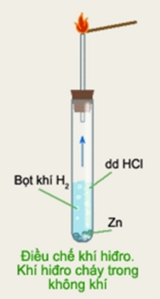
HS vẽ hình mô tả thí nghiệm dùng ống nghiệm điều chế hiđro và đốt cháy khí hiđro trong không khí và nhận xét hiện tượng:
- Có các bọt khí xuất hiện trên bề mặt mảnh kẽm rồi thoát ra khỏi lòng chất lỏng, mảnh kẽm tan dần
- Đưa que đóm còn tàn đỏ vào đầu ống dẫn khí, khí thoát ra không làm cho than hồng bùng cháy
- Đưa que đóm đang cháy vào đầu ống dẫn khí, khí thoát ra sẽ cháy được trong không khí với ngọn lửa màu xanh nhạt, đó là khí hiđro
- Cô cạn một giọt dung dịch, sẽ được chất rắn màu trắng đó là ZnCl2
Phản ứng hóa học xảy ra: Zn + 2HCl → ZnCl2 + H2↑
Trong phòng thí nghiệm, điều chế hiđro bằng cách cho kim loại kẽm (hoặc sắt, nhôm) tác dụng với dung dịch HCl, H2SO4 loãng
Thu khí H2 vào ống nghiệm bằng cách đẩy không khí hoặc đẩy nước
Nhận ra H2 bằng que đóm đang cháy
2. Trong công nghiệp. Điều chế H2 trong công nghiệp bằng cách điện phân nước hoặc dùng than khử oxi của H2O trong lò khí than hoặc điều chế H2 từ khí tự nhiên, dầu mỏ.
II. Phản ứng thế là gì?
Trong hai phản ứng
Zn + 2HCl → ZnCl2 + H2↑
Fe + H2SO4 → FeSO4 + H2↑
Nguyên tử của đơn chất Zn và Fe đã thay thế nguyên tử hiđro của HCl và H2SO4
Phản ứng thế là phản ứng hóa học trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
2. Bài tập
1. Trang 123 Vở bài tập Hóa học 8 :
Những phản ứng hóa học nào dưới đây có thể dùng để điều chế hiđro trong phòng thí nghiệm?
a. Zn + H2SO4 → ZnSO4 + H2
b. 2H2O điệnphân→ 2H2 + O2
c. 2Al + 6HCl → 2AlCl3 + 3H2
Lời giải
Những phản ứng được dùng để điều chế hiđro trong phòng thí nghiệm:
a. Zn + H2SO4 → ZnSO4 + H2
c. 2Al + 6HCl → 2AlCl3 + 3H2
2. Trang 123 Vở bài tập Hóa học 8 : Lập phương trình hóa học của phản ứng sau đây và cho biết chúng thuộc loại phản ứng hóa học nào?
a. Mg + O2 → MgO
b. KMnO4 to→ K2MnO4 + MnO2 + O2
c. Fe + CuCl2 → FeCl2 + Cu
Lời giải
| Phản ứng | Thuộc loại |
|---|---|
| a. Mg + O2 → MgO | Phản ứng hóa hợp |
| b. KMnO4 to→ K2MnO4 + MnO2 + O2 | Phản ứng phân hủy |
| c. Fe + CuCl2 → FeCl2 + Cu | Phản ứng thế |
3. Trang 123 Vở bài tập Hóa học 8 : Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm như thế nào? Vì sao? Đối với khí hiđro, có làm như thế được không? Vì sao?
Lời giải
Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm nằm thẳng đứng, miệng ống nghiệm hướng lên trên vì trọng lượng khí oxi (32g) lớn hơn trọng lượng không khí (29g).
Đối với khí hiđro thì không thể được vì trọng lượng khí hiđro rất nhẹ (2g) so với không khí (29g). Đối với khí H2 thì phải đặt ống nghiệm thẳng đứng và miệng ống nghiệm hướng xuống dưới.
4. Trang 123 Vở bài tập Hóa học 8 :Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng:
a. Viết phương trình hóa học có thể điều chế hiđro;
b. Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để điều chế được 2,24 lít khí hiđro (ở đktc)?
Lời giải
a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2 ↑ (1)
Zn + H2SO4 → ZnSO4 + H2 ↑ (2)
Fe + H2SO4 (loãng) → FeSO4 + H2 ↑ (3)
Fe + 2HCl → FeCl2 + H2 ↑ (4)
b. Số mol khí hiđro là: n = (2,24)/(22,4)= 0,1 (mol)
Theo phương trình để có 1mol H2 cần 1 mol Zn
(1) và (2): ∑ nZn = ∑ nH2 = 0,1 (mol)
Khối lượng kẽm cần dùng là: m = 0,1.65 = 6,5 (g)
Theo phương trình hóa học (3) và (4): ∑ nFe = ∑ nH2 = 0,1 (mol)
Khối lượng sắt cần dùng là: m = 0,1.56 = 5,6 (g).
5. Trang 123 Vở bài tập Hóa học 8 : Cho 22,4 g sắt tác dụng với dung dịch loãng có chứa 24,5 g axit sunfuric.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí hiđro thu được ở đktc.
Lời giải
a) Phương trình hóa học: Fe + H2SO4 → FeSO4 + H2 ↑
Số mol Fe: nFe = (22,4)/56 = 0,4 mol. Số mol H2SO4: nH2SO4 = (24,5)/98 = 0,25 mol
Theo phương trình, cứ 1 mol sắt tác dụng với 1 mol H2SO4.
Vậy 0,25 mol sắt tác dụng thì cần 0,25 mol H2SO4.
Chất còn dư là Fe (n = 0,15mol; m = 0,15.56 = 84g)
b) Số mol H2 thu được là: nH2 = nFe = 0,25 mol
Thể tích H2: VH2 = 0,25.22,4 = 5,6 lít
B - Giải bài tập
33.1. Trang 124 Vở bài tập Hóa học 8 : Cho các phản ứng hoá học sau :
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Na2O + H2O → 2NaOH
Fe + 2HCl → FeCl2 + H2 ↑
CuO + 2HCl →CuCl2 + H2O
2Al + 3H2SO4 →Al2(SO4)3 + 3H2 ↑
Mg + CuCl2 → MgCl2 + Cu ↓
CaO + CO2 → CaCO3
HCl + NaOH → NaCl + H2O
Số phản ứng thuộc loại phản ứng thế là
A. 3.
B. 4.
C. 5.
D. 6.
Lời giải
Chọn B
Đó là các phản ứng (1) (3) (5) (6)
33.5. Trang 124 Vở bài tập Hóa học 8 : Trong phòng thí nghiệm có các kim loại kẽm và magie, các dung dịch axit sunfuric loãng H2SO4 và axit clohiđric HCl.
a) Hãy viết các phương trình hoá học của phản ứng để điều chế khí H2.
b) Muốn điều chế được 1,12 lít khí hiđro (đktc) phải dùng kim loại nào, axit nào để chỉ cần một khối lượng nhỏ nhất ?
Lời giải
a) Phương trình hoá học của phản ứng điều chế H2:
Zn + 2HCl → ZnCl2 + H2↑ (1)
Zn + H2SO4 → ZnSO4 + H2 ↑ (2)
Mg + 2HCl → MgCl2 + H2 ↑ (3)
Mg + H2SO4 →MgSO4 + H2 ↑(4)
b) Xác định phản ứng điều chế hidro dùng khối lượng kim loại và axit nhỏ nhất:
Muốn điều chế 1,12 lít khí hiđro với khối lượng kim loại và axit nhỏ nhất cần phải dùng kim loại magie và axit clohiđric. Theo các phương trình hoá học trên thì khối lượng nguyên tử Mg nhỏ hơn khối lượng nguyên tử Zn. Khối lượng phân tử axit HCl nhỏ hơn khối lượng phân tử axit H2SO4
33.11. Trang 125 Vở bài tập Hóa học 8 : Điện phân hoàn toàn 2 lít nước ở trạng thái lỏng (biết khối lượng riêng D của nước là 1 kg/lít), thể tích khí hiđro và thể tích khí oxi thu được (ở đktc) lần lượt là
A. 1244,4 lít và 622,2 lít.
B. 3733,2 lít và 1866,6 lít.
C. 4977,6 lít và 2488,8 lít.
D. 2488,8 lít và 1244,4 lít.
Lời giải
Chọn D
Phương trình hóa học của phản ứng điện phân nước :
2H2O điện phân⟶ 2H2 + O2
2 mol 2 mol 1 mol
Tính số mol oxi: nO2 = (2.2.1000)/(18.2) = 111,11 mol
Tính số mol hidro: nH2 = (2.1000)/(18.2) = 55,555 mol
Tính thể tích oxi: VO2 = 111,11 . 22,4 = 2488,8 lít
Tính thể tích hidro: VH2 = 55,555 . 22,4 = 1244,4 lít
33.12. Trang 125 Vở bài tập Hóa học 8 :So sánh thể tích khí hiđro (đktc) thu được trong mỗi trường hợp sau :
a) 0,1 mol Zn tác dụng với dung dịch H2SO4 loãng, dư.
0,1 mol Al tác dụng với dung dịch H2SO4 loãng, dư.
b) 0,2 mol Zn tác dụng với dung dịch HCl dư.
0,2 mol Al tác dụng với dung dịch HCl dư.
Lời giải
a) Phương trình hóa học Zn tác dụng với dung dịch H2SO4 loãng, dư:
Zn + H2SO4 → ZnSO4 + H2
1 mol 1 mol
Số mol hidro sinh ra: nH2 = nZn = 0,1 mol
Phương trình hóa học Al tác dụng với dung dịch H2SO4 loãng, dư
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
2 mol 3 mol
Số mol hidro sinh ra: nH2 = (0,1.3)/2 = 0,15 mol
So sánh 0,15 > 0,1mol
b) Phương trình hóa học Zn tác dụng với dung dịch HCl loãng, dư:
Zn + 2HCl → ZnCl2 + H2
1 mol 1 mol
Số mol hidro sinh ra: nH2 = nZn = 0,2 mol
Phương trình hóa học Al tác dụng với dung dịch HCl loãng, dư
2Al + 6HCl → 2AlCl3 + 3H2
2 mol 3 mol
Số mol hidro sinh ra: nH2 = (0,2.3)/2 = 0,3 mol
So sánh 0,3 > 0,2mol


