Trắc nghiệm Hóa học 10 Chủ đề 3 (có đáp án): Liên kết hóa học - Cánh diều
Haylamdo biên soạn và sưu tầm 50 bài tập trắc nghiệm Hóa học 10 Chủ đề 3: Liên kết hóa học sách Cánh diều có đáp án và lời giải chi tiết đầy đủ các mức độ sẽ giúp học sinh ôn luyện trắc nghiệm để biết cách làm các dạng bài tập Hóa 10
Trắc nghiệm Hóa học 10 Chủ đề 3 (có đáp án): Liên kết hóa học - Cánh diều
Trắc nghiệm Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Câu 1:
Theo quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng
A. nhận electron để hình thành lớp vỏ bền vững.
B. nhường electron để hình thành lớp vỏ bền vững.
C. hình thành lớp vỏ bền vững như của khí hiếm.
D. góp chung electron để hình thành lớp vỏ bền vững.
Câu 2:
Cho nguyên tử các nguyên tố sau: Na (Z = 11); P (Z = 15); Ne (Z = 10). Trong các nguyên tử trên, nguyên tử có lớp electron ngoài cùng bền vững là
A. Ne.
B. Na.
C. P.
D. Ne và Na.
Câu 3:
Nguyên tử chlorine có Z = 17. Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Câu 4:
Oxygen có Z = 8, xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học là
A. nhận 2 electron.
B. nhường 2 electron.
C. nhận 1 electron.
D. nhường 1 electron.
Câu 5:
Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng
A. nhường 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
B. nhường 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
C. nhận 3, 2 hoặc 1 electron để đạt 8 electron ở lớp ngoài cùng.
D. nhận 5, 6 hoặc 7 electron để đạt 8 electron ở lớp ngoài cùng.
Câu 6:
Nguyên tử sodium có Z = 11. Xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là
A. nhường 2 electron.
B. nhường 1 electron.
C. nhận 2 electron.
D. nhận 1 electron.
Câu 7:
Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng
A. nhận 1, 2 hoặc 3 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
B. nhận 7, 6 hoặc 5 electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
C. nhường 7, 6 hoặc 5 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
D. nhường 1, 2 hoặc 3 electron để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
Câu 8:
Phân tử H2 được hình thành từ
A. 2 nguyên tử H, trong đó mỗi nguyên tử H nhường đi 1 electron.
B. 2 nguyên tử H bởi sự góp chung electron.
C. 2 nguyên tử H, trong đó mỗi nguyên tử H nhận thêm 1 electron.
D. 2 nguyên tử H, trong đó 1 nguyên tử H nhận thêm 1 electron và 1 nguyên tử H nhường đi 1 electron.
Câu 9:
Nguyên tử P (Z = 15) có xu hướng
A. nhường 5 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhận 3 electron.
Câu 10:
Nguyên tử Al (Z = 13) có xu hướng
A. nhận 3 electron.
B. nhường 3 electron.
C. nhận 5 electron.
D. nhường 5 electron.
Câu 11:
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Boron (Z = 5).
B. Potassium (Z = 19).
C. Magnesium (Z = 12).
D. Flourine (Z = 9).
Câu 12:
Cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Phần trăm khối lượng của R trong oxide cao nhất là
A. 25,81%.
B. 67,82%.
C. 32,18%.
D. 74,19%.
Câu 13:
Cation M+ và anion X- đều có cấu hình electron phân lớp ngoài cùng là 3p6. Cho đơn chất M tác dụng với đơn chất X thu được sản phẩm là
A. NaCl.
B. KCl.
C. NaBr.
D. KBr.
Câu 14:
Cho 6,72 gam một kim loại M tác dụng với dung dịch H2SO4 loãng, dư, thu được 2,688 lít khí (ở đktc). Kim loại M là
A. Mg.
B. Fe.
C. Zn.
D. Al.
Câu 15:
Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với lượng dư dung dịch HCl, sau phản ứng thu được 6,72 lít khí ở đktc. Hai kim loại đó là
A. Be và Mg.
B. Ca và Sr.
C. Mg và Ca.
D. Sr và Ba.
Câu 1:
Liên kết ion được hình thành bởi
A. lực hút tĩnh điện giữa hai ion âm.
B. lực hút tĩnh điện giữa hai ion dương.
C. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
D. lực đẩy giữa các ion mang điện tích trái dấu.
Câu 2:
Khi các phần tử mang điện tích trái dấu hút nhau tạo thành liên kết hóa học, năng lượng của hệ sẽ
A. tăng lên.
B. giảm đi.
C. không thay đổi.
D. tăng sau đó giảm đi.
Câu 3:
Phát biểu nào sau đây không đúng?
A. Liên kết ion chỉ có trong hợp chất.
B. Các hợp chất được tạo nên từ cation và anion gọi là hợp chất ion.
C. Liên kết ion được hình thành giữa kim loại điển hình và phi kim điển hình.
D. Hợp chất KNO3 tạo nên bởi các ion đơn nguyên tử.
Câu 4:
Hợp chất ion nào sau đây được tạo nên bởi các ion đa nguyên tử?
A. NH4NO3.
B. Na2CO3.
C. NaCl.
D. CuSO4.
Câu 5:
Phương trình nào sau đây không đúng khi biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng?
D. Cl + 1e Cl-.
Câu 6:
Nguyên tử O có Z = 8. Cấu hình electron của ion O2- là
A. 1s22s22p4.
B. 1s22s22p6.
C. 1s22s22p43s2.
D. 1s22s22p2.
Câu 7:
Nguyên tử Al có Z = 13. Cấu hình electron của ion Al3+ là
A. 1s22s22p63s23p1.
B. 1s22s22p63s23p4.
C. 1s22s22p63s2.
D. 1s22s22p6.
Câu 8:
A. Nguyên tử K nhường 1 electron tạo thành cation K+, nguyên tử Cl nhận 1 electron tạo thành anion Cl-. Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
Câu 10:
Tinh thể ion là tinh thể được tạo nên bởi
A. các cation.
B. các anion.
C. các cation và anion.
D. các cation và anion Cl-.
Câu 11:
Ở điều kiện thường, hợp chất ion thường tồn tại ở dạng
A. khí.
B. lỏng.
C. tinh thể rắn.
D. rắn hoặc khí.
Câu 12:
Phát biểu nào sau đây là đúng?
Hợp chất tạo nên bởi ion Fe3+ và O2- là hợp chất
(a) cộng hóa trị(b) ion
(c) có công thức Fe2O3 (d) có công thức Fe3O2
A. (b) và (c).
B. (a) và (b).
C. (c) và (d).
D. (b) và (d).
Câu 13:
Cation R2+ có cấu hình electron ở phân lớp ngoài cùng là 3p6. Xác định vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học.
A. Ô 20, chu kì 3, nhóm IIA.
B. Ô 20, chu kì 4, nhóm IIA.
C. Ô 18, chu kì 3, nhóm VIIIA.
D. Ô 18, chu kì 4, nhóm VIIIA.
Câu 14:
Nguyên tử potassium có Z = 19, nguyên tử flourine có Z = 9. Hãy dự đoán về kiểu liên kết giữa flourine và potassium.
A. Liên kết cho – nhận.
B. Liên kết cộng hóa trị.
C. Liên kết ion.
D. Không xác định được.
Câu 15:
Hợp chất ion X được tạo bởi cation Na+ và ion đa nguyên tử . Cho 15,9 gam X tác dụng với dung dịch HCl dư thu được V lít khí (ở đktc). Giá trị của V là
A. 1,12.
Câu 1:
Liên kết cộng hóa trị là liên kết được hình thành bởi
A. lực hút tĩnh điện giữa các ion trái dấu.
B. một hay nhiều cặp electron chung giữa hai nguyên tử.
C. lực hút tĩnh điện giữa các ion cùng dấu.
D. sự cho và nhận electron giữa hai nguyên tử.
Câu 2:
Liên kết giữa nguyên tử H và F trong phân tử HF được tạo nên bởi
A. 1 cặp electron chung.
B. 2 cặp electron chung.
C. 3 cặp electron chung.
D. 4 cặp electron chung.
Câu 3:
Công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng gọi là
A. công thức cộng hóa trị.
B. công thức electron.
C. công thức Lewis.
D. công thức ion.
Câu 4:
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn
A. bằng một mũi tên () và goi là liên kết đơn.
B. bằng một nối ba () và goi là liên kết ba.
C. bằng một nối đôi (=) và goi là liên kết đôi.
D. bằng một nối đơn (–) và goi là liên kết đơn.
Câu 6:
Liên kết giữa 2 nguyên tử N trong phân tử N2 là
A. liên kết đôi.
B. liên kết ba.
C. liên kết đơn.
D. liên kết ion.
Câu 7:
Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là
A. liên kết ion.
B. liên kết hiđro.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Câu 9:
Nguyên tử A và B có độ âm điện lần lượt là (A) , (B) ((B) ≥ (A) ). Hiệu độ âm điện giữa hai nguyên tử A, B là = (B) - (A). Nếu liên kết giữa hai nguyên tử A và B là liên kết cộng hóa trị có cực thì
A. 0 ≤ < 0,4.
B. 0,4 ≤ < 1,7.
C. ≥ 1,7.
D. 1,7 ≤ < 4,0.
Câu 10:
Liên kết giữa hai nguyên tử Cl trong phân tử Cl2 là
A. liên kết cộng hóa trị không cực.
B. liên kết cộng hóa trị có cực.
C. liên kết ion.
D. liên kết cho – nhận.
Câu 11:
Cho biết độ âm điện của nguyên tử H và Cl lần lượt là 2,2 và 3,2. Liên kết giữa nguyên tử H và Cl trong phân tử HCl là
A. liên kết ion.
B. liên kết cộng hóa trị không cực.
C. liên kết cộng hóa trị có cực.
D. liên kết cho – nhận.
Câu 12:
Liên kết ba gồm
A. 3 liên kết .
B. 1 liên kết và 2 liên kết .
C. 2 liên kết và 1 liên kết .
D. 1 liên kết và 1 liên kết .
Câu 13:
Cho các phát biểu sau:
(1) Trong phân tử HCl, cặp electron chung bị lệch về phía nguyên tử H.
(2) Liên kết kém bền hơn liên kết .
(3) Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma ().
(4) Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi ().
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14:
Năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar được gọi là
A. năng lượng nguyên tử.
B. năng lượng hạt nhân.
C. năng lượng liên kết.
D. năng lượng hóa học.
Câu 15:
Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 KJ mol-1; H–Br là 364 KJ mol-1; H–I là 297 KJ mol-1. Trong các liên kết trên, liên kết nào bền nhất?
A. H–F.
B. H–Cl.
C. H–Br.
D. H–I.
Câu 1:
Liên kết hydrogen là
A. liên kết được hình thành bởi lực hút tĩnh điện giữa các ion trái dấu.
B. liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
C. liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
D. liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Câu 2:
Những liên kết có lực liên kết yếu như
A. liên kết hydrogen và tương tác van der Waals.
B. liên kết ion và liên kết cộng hóa trị.
C. liên kết ion và liên kết hydrogen.
D. liên kết hydrogen và liên kết cộng hóa trị.
Câu 3:
Liên kết hydrogen không được hình thành giữa hai phân tử nào sau đây?
A. 2 phân tử H2O.
B. 2 phân tử HF.
C. 1 phân tử H2O và 1 phân tử CH4.
D. 1 phân tử H2O và 1 phân tử NH3.
Câu 4:
Phát biểu nào sau đây không đúng?
A. Liên kết hydrogen có bản chất tĩnh điện.
B. Ở nhiệt độ thấp, hydrogen fluoride (HF) tồn tại ở thể rắn dưới dạng polimer (HF)n nhờ liên kết hydrogen.
C. HF có tính acid mạnh hơn nhiều so với HCl.
D. Độ dài liên kết là khoảng cách giữa hai hạt nhân của hai nguyên tử tham gia liên kết.
Câu 5:
Liên kết hydrogen và tương tác van der Waals làm
A. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
C. tăng nhiệt độ nóng chảy và giảm nhiệt độ sôi của các chất.
D. giảm nhiệt độ nóng chảy và tăng nhiệt độ sôi của các chất.
Câu 6:
Một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử, gọi là
A. liên kết cộng hóa trị.
B. liên kết ion.
C. tương tác van der Waals.
D. liên kết cho – nhận.
Câu 8:
Trong dãy HX, các acid HCl, HBr, HI là axit mạnh nhưng HF là axit yếu. Đó là do
A. trong phân tử HF có tương tác van der Waals.
B. trong phân tử HF có liên kết hydrogen.
C. khối lượng phân tử HF nhỏ hơn nhiều so với các acid khác.
D. năng lượng liên kết của H-F lớn hơn nhiều các liên kết H-X khác.
Câu 9:
Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc chính vào yếu tố nào?
A. Hai yếu tố: khối lượng phân tử và liên kết giữa các phân tử.
B. Hai yếu tố: số lượng nguyên tử trong phân tử và liên kết giữa các phân tử.
C. Chỉ phụ thuộc vào khối lượng phân tử.
D. Chỉ phụ thuộc vào liên kết giữa các phân tử.
Câu 10:
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì
B. nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng ổn định.
A. nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng thấp.
C. nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
D. nhiệt độ nóng chảy của chất đó càng cao và nhiệt độ sôi của chất đó càng thấp.
Câu 11:
Tại áp suất 1 bar, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và (xấp xỉ) 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn nước. Tính chất này là do
A. các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết ion.
B. các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết cộng hóa trị.
C. các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
D. các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết cho – nhận.
Câu 12:
Cho các phát biểu sau:
(a) Quá trình chưng cất rượu, C2H5OH bay trước H2O mặc dù khối lượng phân tử C2H5OH lớn hơn khác nhiều khối lượng phân tử H2O.
(b) Khối lượng phân tử càng lớn thì nhiệt độ nóng chảy, nhiệt độ sôi càng thấp.
(c) Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử.
(d) Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng mạnh hơn so với liên kết hydrogen.
Trong các phát biểu trên, số phát biểu đúng là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 13:
Ảnh hưởng nào của liên kết hydrogen đến tính chất của các chất không đúng?
A. Làm tăng nhiệt độ nóng chảy của các chất.
B. Làm giảm độ điện li, tính axit của các chất.
C. Làm giảm độ tan của các chất.
D. Làm tăng nhiệt độ sôi của các chất.
Câu 14:
So sánh nhiệt độ sôi và nhiệt độ nóng chảy của các chất F2, Cl2, Br2, I2.
A. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 > Cl2 > Br2 > I2.
B. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 < Cl2
C. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 > Br2 > I2 > Cl2.
D. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 > Br2.
Câu 15:
Cho sơ đồ liên kết giữa hai phân tử acid CH3COOH:
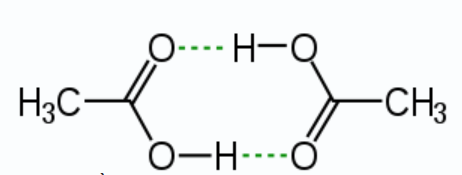
Trong sơ đồ trên, đường nét đứt đại diện cho
A. liên kết cộng hóa trị có cực.
B. liên kết ion.
C. liên kết cho – nhận.
D. liên kết hydrogen.

