Lý thuyết KHTN 8 Kết nối tri thức Bài 2: Phản ứng hóa học
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Khoa học tự nhiên 8 Bài 2: Phản ứng hóa học sách Kết nối tri thức hay nhất, ngắn gọn sẽ giúp học sinh lớp 8 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 8.
Lý thuyết KHTN 8 Kết nối tri thức Bài 2: Phản ứng hóa học
I. Biến đổi vật lí và biến đổi hoá học
- Các quá trình như hoà tan, đông đặc, nóng chảy, … các chất chỉ chuyển từ trạng thái này sang trạng thái khác, không tạo thành chất mới, đó là biến đổi vật lí.
- Các quá trình như đốt cháy nhiên liệu, phân huỷ chất (ví dụ: nung đá vôi,…), tổng hợp chất (ví dụ: quá trình quang hợp,…),… có sự tạo thành chất mới, đó là biến đổi hoá học.
- Trong cơ thể người và động vật, sự trao đổi chất là một loạt các quá trình sinh hoá, đó là những quá trình phức tạp, bao gồm cả biến đổi vật lí và biến đổi hoá học.
II. Phản ứng hoá học
1. Khái niệm
- Quá trình biến đổi từ chất này thành chất khác được gọi là phản ứng hoá học. Chất ban đầu bị biến đổi trong phản ứng được gọi là chất phản ứng hay chất tham gia. Chất mới sinh ra được gọi là sản phẩm.
- Phản ứng hoá học được biểu diễn bằng phương trình dạng chữ như sau:
Tên các chất phản ứng → Tên các chất sản phẩm
Ví dụ:
Iron + Sulfur → Iron(II) sulfide
Đọc là: iron tác dụng với sulfur tạo thành iron(II) sulfide.
Trong đó: iron và sulfur là chất phản ứng; iron(II) sulfide là sản phẩm.
- Trong quá trình phản ứng, lượng chất phản ứng giảm dần, lượng sản phẩm tăng dần.
- Phản ứng xảy ra hoàn toàn khi có ít nhất một chất phản ứng đã phản ứng hết.
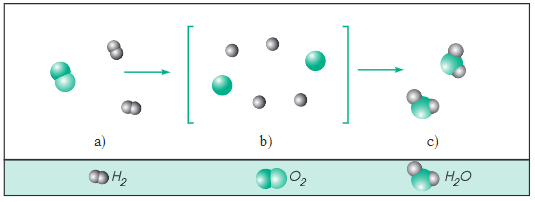
2. Diễn biến phản ứng hoá học
- Trong phản ứng hoá học, xảy ra sự phá vỡ các liên kết trong phân tử chất đầu, hình thành các liên kết mới, tạo ra các phân tử mới. Kết quả là chất này biến đổi thành chất khác.
- Các phản ứng hoá học chỉ xảy ra khi các chất phản ứng tiếp xúc với nhau. Nhiều phản ứng để xảy ra được cần phải có thêm điều kiện là đun nóng. Một số phản ứng muốn xảy ra nhanh hơn cần có thêm chất xúc tác,…
3. Hiện tượng kèm theo các phản ứng hoá học
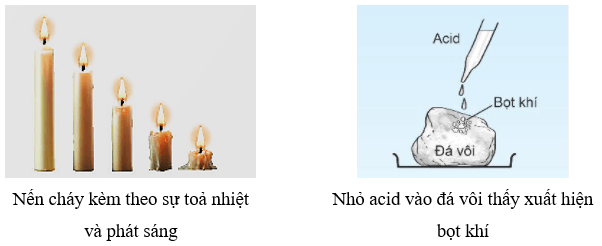
- Phản ứng hoá học xảy ra khi có chất mới được tạo thành với những tính chất mới, khác biệt với chất ban đầu.
- Những dấu hiệu có thể nhận ra có chất mới tạo thành là sự thay đổi về màu sắc, xuất hiện chất khí hoặc xuất hiện chất kết tủa,… Sự toả nhiệt và phát sáng cũng có thể là dấu hiệu cho biết phản ứng hoá học đã xảy ra.
III. Năng lượng của phản ứng hoá học
1. Phản ứng toả nhiệt, phản ứng thu nhiệt
- Phản ứng toả nhiệt giải phóng năng lượng (dạng nhiệt) ra môi trường xung quanh.
Ví dụ: Đốt đèn cồn, cồn (ethanol) cháy. Khi đó, ethanol và khí oxygen trong không khí đã tác dụng với nhau tạo thành hơi nước và khí carbon dioxide, đồng thời giải phóng năng lượng dưới dạng nhiệt. Ta nói, phản ứng đốt cháy cồn là phản ứng toả nhiệt.
- Phản ứng thu nhiệt nhận năng lượng (dạng nhiệt) trong suốt quá trình phản ứng xảy ra.
Ví dụ: Với phản ứng phân huỷ copper(II) hydroxide thành copper(II) oxide và hơi nước thì cần cung cấp năng lượng dưới dạng nhiệt bằng cách đun nóng. Khi ngừng cung cấp nhiệt, phản ứng cũng dừng lại. Ta nói, phản ứng phân huỷ copper(II) hydroxide là phản ứng thu nhiệt.
2. Ứng dụng của phản ứng toả nhiệt
Các phản ứng toả nhiệt có vai trò quan trọng trong cuộc sống vì chúng cung cấp năng lượng cho sinh hoạt và sản xuất, vận hành động cơ, thiết bị máy công nghiệp, phương tiện giao thông,…