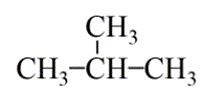Lý thuyết Hóa học 11 Cánh diều Bài 12: Alkane
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 12: Alkane sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Cánh diều Bài 12: Alkane
I. Khái niệm và danh pháp
1. Khái niệm
- Alkane là hydrocarbon mạch hở, trong phân tử chỉ có liên kết đơn.
- Alkane có công thức chung là CnH2n+2 ( n1).
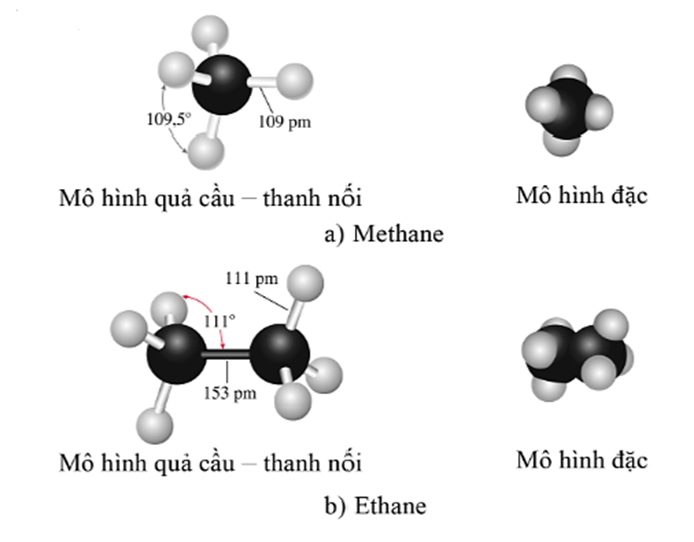
- Mỗi nguyên tử carbon trong phân tử alkane nằm ở tâm một hình tứ diện, liên kết với bốn nguyên tử (hay nhóm nguyên tử) nằm ở bốn đỉnh của hình tứ diện đó.
Ví dụ mô hình phân tử các alkane có công thức phân tử CH4 (methane) và C2H6 (ethane):
2. Đồng phân
- Các alkane có từ bốn nguyên tử trở lên có đồng phân về mạch carbon.
- Các alkane mạch không phân nhánh có mạch carbon mà trong đó mỗi nguyên tử carbon chỉ liên kết tối đa với hai nguyên tử carbon khác.
- Alkane mạch phân nhánh chứa nguyên tử carbon liên kết với ba hoặc bốn nguyên tử carbon khác.
Ví dụ: Ứng với alkane có công thức phân tử C4H10 có các đồng phân:
CH3 – CH2 – CH2 – CH3
3. Danh pháp
- Với alkane mạch phân nhánh, mạch carbon dài nhất là mạch chính, các mạch carbon còn lại là mạch nhánh. Mạch nhánh được xem là nhóm thế alkyl của mạch chính. Đánh số các nguyên tử carbon trên mạch chính từ đầu gần mạch nhánh nhất để tổng số chỉ vị trí các nhánh là nhỏ nhất.
Khi đó tên alkane mạch phân nhánh được gọi như sau:
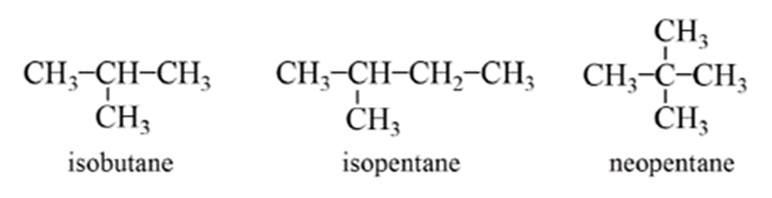
- Một số alkane có tên riêng:
II. Tính chất vật lí
- Ở điều kiện thường, methane, ethane, propane và butane là các chất khí; các alkane có số nguyên tử carbon lớn hơn (trừ neopentane) là chất lỏng hoặc chất rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các alkane nhìn chung tăng theo khối lượng phân tử.
- Tất cả các alkane đều nhẹ hơn nước, kém tan trong nước và tan nhiều trong dung môi hữu cơ không phân cực.
III. Tính chất hóa học
Ở điều kiện thường, các alkane kém hoạt động về mặt hoá học. Khi được chiếu sáng hoặc đun nóng, chúng trở nên hoạt động hơn.
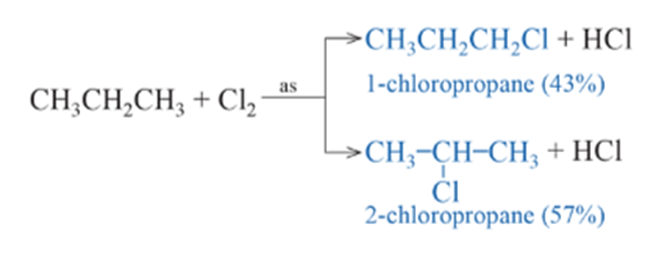
1. Phản ứng thế halogen
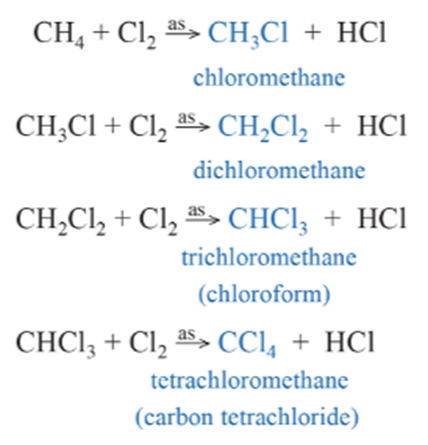
- Trong điều kiện thích hợp (ánh sáng, đun nóng), alkane có thể phản ứng với halogen (chlorine, bromine). Phản ứng xảy ra theo từng nấc để tạo thành lần lượt các dẫn xuất monohalogen (chỉ chứa một nguyên tử halogen), dihalogeno (chứa hai nguyên tử halogen), trihalogeno (chứa ba nguyên tử halogen) …
Ví dụ phản ứng thế chlorine vào methane:
- Trong phản ứng thế halogen, nguyên tử H ở carbon bậc cao hơn dễ bị thế bởi nguyên tử halogen hơn nguyên tử H ở carbon bậc thấp. Ví dụ:
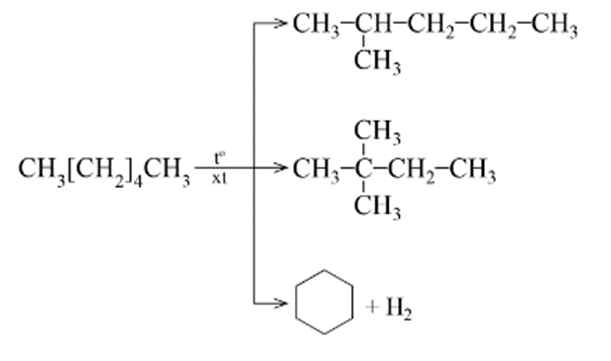
2. Phản ứng cracking và phản ứng reforming
- Ở điều kiện nhiệt độ cao và có mặt chất xúc tác thích hợp, phản ứng cracking alkane xảy ra và tạo thành những hợp chất có mạch carbon ngắn hơn. Ví dụ:
C16H34 C10H22 + C6H12
- Cũng trong điều kiện này còn xảy ra phản ứng refoming, tạo thành sản phẩm có nhiều mạch nhánh hoặc mạch vòng. Ví dụ:
3. Phản ứng oxi hóa
- Ở nhiệt độ cao, các alkane bị oxi hóa bởi oxygen. Có thể xảy ra phản ứng oxi hóa hoàn toàn (tạo thành carbon dioxide) hay phản ứng không hoàn toàn tùy thuộc vào điều kiện phản ứng). Ví dụ:
IV. Nguồn alkane trong tự nhiên, ứng dụng của alkane
1. Nguồn alkane trong tự nhiên – Điều chế alkane trong công nghiệp
- Alkane dùng trong công nghiệp được lấy từ nguồn alkane trong tự nhiên (gồm dầu mỏ, khí thiên nhiên và khí mỏ dầu).
- Methane là thành phần chính của khí thiên nhiên và được sinh ra trong một số quá trình phân hủy sinh học.
- Dầu mỏ là nguồn quan trọng cung cấp hydrocarbon nói chung là alkane nói riêng. Các phân đoạn hydrocarbon (chủ yếu là alkane) có nhiệt độ sôi khác nhau được phân tách khỏi nhau bằng chưng cất phân đoạn dầu mỏ.
2. Ứng dụng
- Alkane là thành phần chính của các loại nhiên liệu trong đời sống (khí đốt, xăng, LPG, dầu hỏa, dầu diesel, dầu đốt).
- Ngoài được dùng làm nhiên liệu, methane còn được sử dụng để tổng hợp acetylene, hydrogen…
- Một số alkane lỏng dùng làm nhiên liệu, dung môi pha sơn, chiết hoạt chất làm thuốc…. Các alkane rắn được dùng làm sáp, nến….
3. Nhiên liệu và môi trường
- Khí thải động cơ, ngoài thành phần CO2 và hơi nước còn có thể có CO, NOx và các alkane chưa cháy hết …
- Để giảm bớt tác hại của khí thải với môi trường, bên cạnh việc tăng hiệu suất đốt cháy, người ta còn đưa chất xác tác vào khí thải của động cơ để chuyển hóa alkane, carbon monoxide và các oxide của nitrogen thành carbon dioxide, nitrogen và nước.