Lý thuyết Hóa học 11 Cánh diều Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Cánh diều Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
I. Sự điện li, chất điện li và chất không điện li.
- Quá trình phân li của các chất khi tan trong nước thành các ion gọi là sự điện li.
- Chất điện li là chất khi tan trong nước phân li thành các ion.
- Chất không điện li là chất khi tan trong nước không phân li thành các ion.
- Trong thực tế, người ta thấy rằng:
+ Hầu hết các acid, base và muối tan được trong nước thuộc loại chất điện li.
+ Rất nhiều chất hữu cơ tan được trong nước như đường saccharose (C12H22O11), ethanol, glycerol … là những chất không điện li.
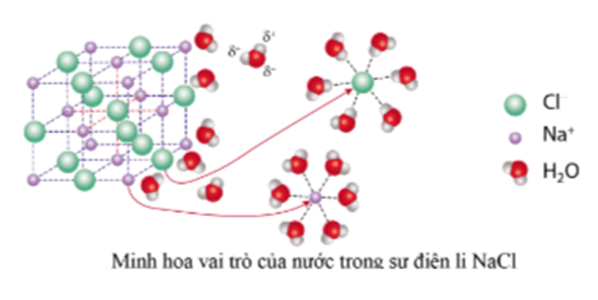
- Nước đóng vai trò quan trọng trong sự điện li của một chất nhờ quá trình phân cực của phân tử nước (các nguyên tử H mang một phần điện tích dương và nguyên tử O mang một phần điện tích âm). Khi hòa tan một chất điện li vào nước, xuất hiện tương tác của nước với các ion, tương tác này sẽ bứt các ion khỏi tinh thể (hoặc phân tử) để tan vào nước.
1. Thuyết Bronsted- Lowry về acid - base
- Theo thuyết Arrenius (A-re-ni-ut), acid là những chất khi tan trong nước phân li ra H+ (proton), base là những chất khi tan trong nước phân li ra ion OH-.
Tuy nhiên thuyết Arrenius còn một số hạn chế như: chỉ áp dụng cho dung môi nước; không giải thích được nhiều trường hợp …
- Năm 1923, Bronsted và Lowry đã đề xuất thuyết về acid - base (Gọi là thuyết Bronsted - Lowry) như sau: Acid là những chất có khả năng cho H+, base là những chất có khả năng nhận H+.
Ví dụ 1: Ammoniac ( NH3) khi tan trong nước có phản ứng với nước:
NH3 + H2O ⇌ NH4+ + OH- (1)
Trong phản ứng thuận của (1), H2O đã nhường H+ cho NH3 nên đóng vai trò là acid, còn NH3 nhận H+ từ H2O nên đóng vai trò là base.
Ví dụ 2: Trong dung dịch nước của acetic acid (CH3COOH) tồn tại cân bằng sau:
CH3COOH + H2O ⇌ H3O+ + CH3COO-
Theo phản ứng thuận, CH3COOH đóng vai trò acid còn H2O đóng vai trò base; theo phản ứng nghịch, H3O+ đóng vai trò acid còn CH3COO- đóng vai trò base.
- Từ 2 ví dụ trên, ta thấy nước được coi là chất lưỡng tính (vừa có tính acid, vừa có tính base).
2. Acid mạnh/ base mạnh và acid yếu/ base yếu.
- Từ sự phân li hoàn toàn và không hoàn toàn của acid và base trong nước, rút ra đặc điểm: Acid mạnh và base mạnh phân li hoàn toàn trong nước (nên không tồn tại dạng phân tử trong nước). Acid yếu và base yếu chỉ phân li một phần trong nước.
- Nhiều acid, base ở dạng ion như NH4+, CH3COO-….,
Ví dụ 3:
+ Các acid như HCl, HNO3, H2SO4… là các acid mạnh và các base như NaOH, Ba(OH)2, Ca(OH)2 … là các base mạnh.
+ Các acid như CH3COOH, H2CO3, H2SO3 là các acid yếu và các gốc acid tương ứng CH3COO- , CO32-, SO32-, …là những base yếu.
- Theo thuyết Bronsted - Lowry , nhiều ion như Fe3+, Al3+, CO32-… sẽ đóng vai trò là acid hoặc base trong nước, bởi chúng tác dụng một phần với nước. Ví dụ:
Al3+ + 3H2O ⇌ Al(OH)3 + 3H+
CO32- + H2O ⇌ HCO3- + OH-
HCO3- + H2O ⇌ H2CO3 + OH-
Các phản ứng trên được gọi là phản ứng thủy phân (tác dụng với nước) của ion Al3+ và ion CO32-.

