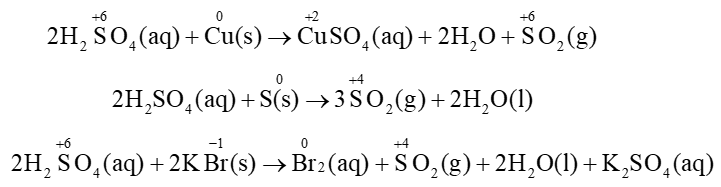Lý thuyết Hóa học 11 Cánh diều Bài 7: Sulfuric acid và muối sulfate
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 7: Sulfuric acid và muối sulfate sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Cánh diều Bài 7: Sulfuric acid và muối sulfate
I. Sulfuric acid
1. Cấu tạo phân tử và tính chất vật lí.
- Sulfuric acid có công thức phân tử H2SO4.
- Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi.
- Dung dịch sulfuric acid đặc có khả năng hút ẩm nên thường được dùng để làm khô hóa chất.
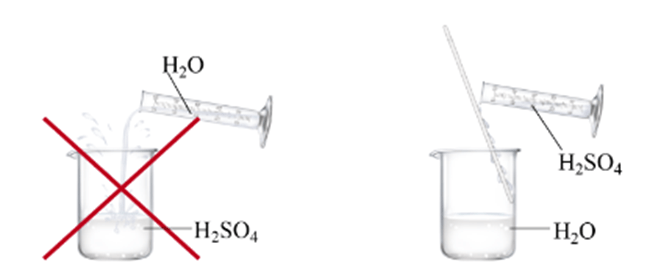
- Sulfuric acid tan tốt trong nước, quá trình hòa tan tỏa ra một lượng nhiệt lớn. Vì vậy, khi pha loãng dung dịch sulfuric acid đặc, phải cho từ từ acid đặc vào nước, không được cho nước vào acid (như hình minh hoạ dưới).
2. Tính chất hóa học
a) Tính chất hóa học của sulfuric acid loãng
Dung dịch sulfuric acid có tính chất chung của một acid:
+ Đổi màu quỳ tím thành đỏ.
+ Tác dụng với những kim loại hoạt động trong dãy hoạt động hóa học. Ví dụ:
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g)
+ Tác dụng với oxide base và base. Ví dụ:
ZnO(s) + H2SO4(aq) → ZnSO4(aq) + H2O(l)
Zn(OH)2(s) + H2SO4(aq) → ZnSO4(aq) + 2H2O(l)
+ Tác dụng với nhiều muối. Ví dụ:
Na2CO3(aq) + H2SO4(aq) → Na2SO4(aq) + CO2(g) + H2O(l)
b) Tính chất hóa học của dung dịch sulfuric acid đặc
* Tính oxi hóa mạnh
- Dung dịch sulfuric acid đặc có tính oxi hóa rất mạnh; oxi hóa được hầu hết các kim loại (trừ vàng, platinum), nhiều phi kim như carbon, sulfur, phosphorus…và nhiều hợp chất. Ví dụ:
* Tính háo nước
- Dung dịch sulfuric acid hấp thụ nước rất mạnh. Nó có khả năng chiếm nước hoặc chiếm các nguyên tố O và H (thành phần của nước) trong nhiều hợp chất. Ví dụ:
Vì vậy, các hợp chất Cn(H2O)m bị than hóa do phản ứng tạo carbon. Một phần carbon sẽ tiếp tục bị oxi hóa bởi acid tạo thành khí.
- Khi bị dính dung dịch sulfuric acid đặc, vùng cơ thể bị tiếp xúc với acid sẽ bị tổn thương nặng do các tế bào bị mất nước, oxi hóa mạnh, bị đốt nóng từ lượng nhiệt lớn phát ra. Vì vậy cần hết sức thận trọng khi sử dụng dung dịch sulfuric acid đặc.
3. Bảo quản và xử lí bỏng sulfuric acid
- Trong phòng thí nghiệm, các chai, lọ chức sulfuric acid phải được bảo quản ở nơi ít có nguy cơ va chạm, xa nguồn nhiệt và các hóa chất khác. Khi làm việc với sulfuric acid, cần sử dụng các dụng cụ bảo hộ như kính bảo hộ, áo bảo hộ và găng tay chống thấm…
- Khi bị bỏng sulfuric acid, cần sơ cứu bằng cách rửa sạch vết bỏng dưới vòi nước sạch trong ít nhất 20 phút. Bỏng sulfuric acid có thể dẫn đến nhiễm trùng máu nếu xử lí không đúng trong bước sơ cứu. Vì thế, chỉ nên dùng nước sạch, tuyệt đối không chườm đá lạnh, không xoa bằng kem, gel, dầu…
4. Ứng dụng và sản xuất sulfuric acid
a) Ứng dụng
-Sulfuric acid được dùng để sản xuất phân bón;
- Ngoài ra acid này còn được sử dụng trong sản xuất nước tẩy rửa, sơn, phẩm màu, thuốc trừ sâu, giấy, chế hóa dầu mỏ…
b) Sản xuất sulfuric acid bằng phương pháp tiếp xúc
- Nguyên liệu chính để sản xuất sulfuric acid bằng phương pháp tiếp xúc là khoáng vật sulfur (S) hoặc khoáng vật pyrite (FeS2)
- Quy trình sản xuất:
+ Trước tiên, sản xuất sulfur dioxide:
+ Sau đó oxi hóa sulfur dioxide:
+ Tiếp theo, sản xuất oleum:
+ Từ oleum pha dung dịch H2SO4
II. Muối sulfate
1. Một số muối sulfate
- Muối sulfate là hợp chất có chứa ion sulfate (). Đa số các muối sulfate tan trong nước, trừ calcium sulfate rất ít tan và barium sulfate không tan.
2. Nhận biết ion SO42- trong dung dịch
- Để nhận biết ion sulfate trong dung dịch, người ta sử dụng muối của barium như barium chloride và barium nitrate. Phàn ứng sinh ra kết tủa màu trắng BaSO4 không tan trong dung dịch acid và dung dịch base.