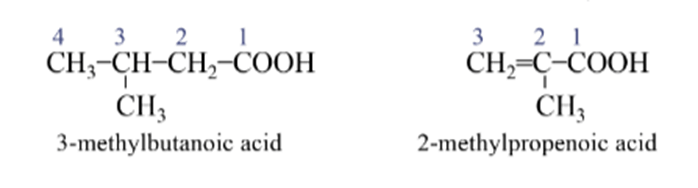Lý thuyết Hóa học 11 Cánh diều Bài 19: Carboxylic acid
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 19: Carboxylic acid sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Cánh diều Bài 19: Carboxylic acid
I. Khái niệm và danh pháp
1. Khái niệm
- Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm carboxyl (-COOH) liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
- Dãy đồng đẳng của carboxylic no, đơn chức, mạch hở có công thức chung là CnH2n+1COOH (n 0).
2. Danh pháp
- Danh pháp thay thế của monocarboxylic acid có mạch carbon no mạch hở:
- Đối với carboxylic acid đơn chức, mạch nhánh hoặc carboxylic acid đơn chức có mạch carbon không no:
Bước 1: Chọn mạch chính là mạch dài nhất, có chứa nhóm – COOH, liên kết bội (nếu có).
Bước 2: Đánh số mạch chính bắt đầu từ nhóm –COOH.
Bước 3: Gọi tên.
Ví dụ:
II. Tính chất vật lí
- Ở điều kiện thường, các carboxylic acid đều ở thể lỏng hoặc rắn.
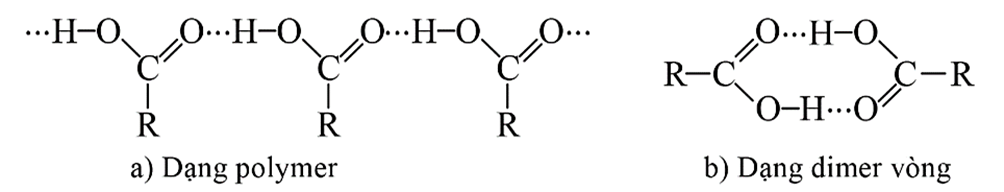
- Nhiệt độ sôi của các carboxylic acid no, đơn chức, mạch hở tăng dần theo chiều tăng của nguyên tử khối. Nhiệt độ sôi của các carboxylic acid cao hơn nhiệt độ sôi của các alcohol có cùng số nguyên tử carbon (do liên hết hydrogen giữa các phân tử acid bền hơn).
- Liên kết hydrogen giữa các phân tử carboxylic acid được thể hiện như sau:
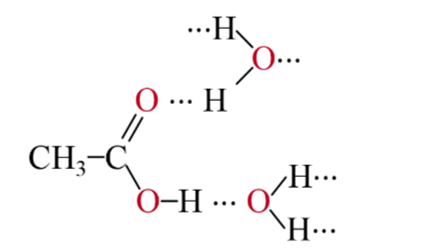
- Do có khả năng tạo liên kết hydrogen với nước nên các carbonxylic acid tan tốt trong nước. Số nguyên tử carbon tăng thì độ tan giảm dần.
Ví dụ liên kết hydrogen giữa phân tử acetic acid và nước:
- Mỗi carboxylic acid có một vị chua riêng biệt. Ví dụ: acetic acid tạo vị chua của giấm; oxalic acid tạo vị chua của me; citric acid tạo vị chua của chanh; tartaric acid tạo vị chua của nho …
III. Tính chất hóa học
Carboxylic acid thể hiện tính acid và tham gia phản ứng ester hoá.
1. Tính acid
- Carboxylic acid điện li không hoàn toàn theo cân bằng:
R-COOH R-COO- + H+
Ka =
- Dung dịch carboxylic acid làm quỳ tím chuyển đỏ.
a) Phản ứng với kim loại trước hydrogen trong dãy hoạt động hoá học của kim loại giải phóng H2. Ví dụ:
2CH3COOH + Mg → (CH3COO)2Mg + H2
b) Phản ứng với các base và oxide base tạo thành muối và nước. Ví dụ:
2CH3COOH + MgO → (CH3COO)2Mg + H2O
CH3COOH + NaOH → CH3COONa + H2O
c) Phản ứng với muối
Ví dụ:
2CH3COOH + Na2CO3 → CH3COONa + H2O + CO2
2. Phản ứng ester hóa
- Phản ứng giữa alcohol và carboxylic acid tạo thành ester được gọi là phản ứng ester hóa. Ester sinh ra thường ít tan trong nước, nổi lên trên và thường có mùi thơm đặc trưng.
- Phương trình tổng quát:
RCOOH + H-O-R’ RCOOR’ + H2O
- Ví dụ:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
- Chú ý: Phản ứng ester hoá diễn ra thuận nghịch và cần chất xúc tác để xảy ra nhanh hơn.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Acetic acid dùng để sản xuất vinyl acetate và cellulose acetate; tổng hợp aluminium monoacetate làm chất cầm màu trong công nghiệp dệt may; tổng hợp ethyl acetate, muối ammonium acetate, phenylacetic acid,… Dung dịch acetic acid 2% - 5% được dùng làm giấm ăn, chất tẩy cặn trong siêu đun nước và nhiều ứng dụng khác.
- Acrylic acid và methacrylic acid được dùng để sản xuất thủy tinh hữu cơ. Benzoic acid với liều lượng nhỏ được dùng làm chất bảo quản thực phẩm. Salicylic acid được dùng để sản xuất thuốc cảm aspirin, thuốc giảm đau. Một số acid béo được dùng để sản xuất xà phòng. Một số dicarboxylic acid tổng hợp polyester, polyamide…để sản xuất tơ sợi.
2. Điều chế
- Điều chế carboxylic acid bằng phương pháp oxi hóa các alkane khai thác từ dầu mỏ:
2R-CH2-CH2-R’ + 5O2 2R-COOH + 2R’-COOH + 2H2O
- Điều chế acetic acid bằng phương pháp oxi hóa butan hoặc lên men giấm:
2CH3CH2CH2CH3 + 5O2 4CH3COOH + 2H2O
C2H5OH + O2 CH3COOH + H2O