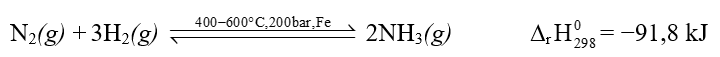Lý thuyết Hóa học 11 Cánh diều Bài 5: Một số hợp chất quan trọng của nitrogen
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 5: Một số hợp chất quan trọng của nitrogen sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Cánh diều Bài 5: Một số hợp chất quan trọng của nitrogen
I. Ammonia
1. Cấu tạo phân tử và tính chất vật lí
|
|
|
|
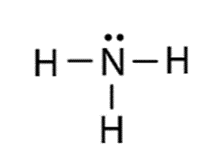
Công thức Lewis của NH3 |
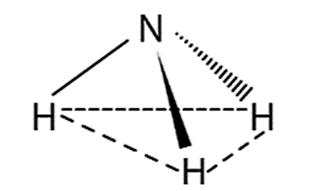
Dạng hình học của NH3 (Hình chóp tam giác) |
- Nhận xét: Các liên kết N−H là liên kết cộng hóa trị phân cực nên các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước.
- Tính chất vật lí của ammonia, NH3:
+ Ammonia tan nhiều trong nước. Ở 20◦C và 1 bar, 1 lit nước có thể hòa tan 700 lít khí ammonia.
+ Ở điều kiện thường, ammonia là chất khí không màu, mùi khai, xốc và độc.
2. Tính chất hóa học
a) Tính base
- Dung dịch ammonia có tính base yếu, làm quỳ tím hóa xanh.
NH3(g) +H2O(l) ⇌ NH4+(aq)+ OH-(aq)
- Khi ammonia hoặc dung dịch ammonia phản ứng với acid tạo ra muối amonium.
NH3(aq) + HCl(aq) → NH4Cl(aq)
- Dung dịch amonia có thể tác dụng với dung dịch muối của một số kim loại để tạo ra các hydroxide của kim loại đó.
MgCl2(aq) + 2NH3(aq) + 2H2O(l) → Mg(OH)2(s) + 2NH4Cl(aq)
b) Tính khử
- Nguyên tử N trong phân tử NH3 có số oxi hóa −3, là số oxi hóa thấp nhất của nguyên tố nitrogen trong các hợp chất. Vì vậy, ammonia thể hiện tính khử khi phản ứng với một số chất có tính oxi hóa.Ví dụ:
(g) + 3O2 (g) 2 (g) + 6H2O(g)
3. Tổng hợp ammonia theo quá trình Haber
Trong công nghiệp, ammonia được tổng hợp theo quá trình Haber (còn gọi Haber – Bosch). Phương trình hóa học:
- Tại thời điểm cân bằng, nồng độ ammonia, nitrogen và hydrogen trong buồng phản ứng là không đổi. Dẫn hỗn hợp khí qua buồng làm lạnh, NH3 lỏng tách ra, hỗn hợp N2, H2 lại tiếp tục được đưa về buồng phản ứng tái sử dụng.
- Để cân bằng chuyển dịch theo chiều thuận, chiều tạo thành ammonia, cần chọn các điều kiện thích hợp về áp suất và nhiệt độ dựa theo nguyên lí chuyển dịch cân bằng Le Chatelier.
+ Áp suất: Tăng áp suất của hệ phản ứng trong buồng tổng hợp nên gần 200 bar.
+ Nhiệt độ: Phản ứng toả nhiệt, nên theo lí thuyết cần giảm nhiệt độ để cân bằng chuyển dịch theo chiều thuận. Tuy nhiên theo thực tế, nếu nhiệt độ quá thấp thì tốc độ phản ứng nhỏ, do đó người ta chọn nhiệt độ thích hợp là 400 – 600oC.
- Việc sử dụng xúc tác trong quá trình Haber có tác dụng làm cho phản ứng nhanh đạt đến trạng thái cân bằng.
II. Muối ammonium
- Muối ammonium là các hợp chất chứa ion ammonium ( ) và gốc acid. Các muối ammonium thường được sử dụng là NH4Cl, NH4NO3, (NH4)2CO3, (NH4)2SO4….
- Hầu hết các muối ammonium tan tốt và điện li hoàn toàn trong nước. Ví dụ:
NH4Cl → + Cl−
- Khi đun nóng hỗn hợp muối ammonium và kiềm ở dạng rắn hoặc dung dịch đều sinh ra khí ammonia có mùi khai và xốc. Đây là phản ứng nhận biết muối ammonium. Ví dụ:
NH4Cl + NaOH NaCl + NH3↑ + H2O
- Các muối ammonium kém bền với nhiệt nên dễ bị phân hủy ở nhiệt độ cao. Các muối ammonium khác nhau phân hủy tạo ra các sản phẩm chứa nitrogen khác nhau. Ví dụ:
NH4Cl NH3 + HCl
NH4NO3 N2O + 2H2O
- Các phản ứng phân hủy muối ammonium đều làm tăng áp suất nên có nguy cơ gây nổ. Vì vậy, việc lưu trữ các phân bón có thành phần chính là muối ammonium thường được khuyến cáo tránh xa các nguồn nhiệt để hạn chế nguy cơ gây cháy nổ.
III. Ứng dụng của ammonium và một số muối ammoium.
- Gần đây, mỗi năm có hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Trong đó, có khoảng 80% được sử dụng cho sản xuất phân đạm chứa gốc ammonium, urea (NH2)2CO…để cung cấp nguyên tố nitrogen cho đất và cây trồng.
- Amonium còn là nguyên liệu quan trọng trong sản xuất nitric acid, sản xuất một số chất gây nổ sử dụng trong khai thác quặng mỏ như ammonium nitrate….
- Giống như nitrogen lỏng, amomonia lỏng cũng được sử dụng với vai trò chất làm lạnh trong một số hệ thống làm lạnh công nghiệp.
- Ammonia lỏng được sử dụng làm dung môi để hòa tan một số chất.
- Ngoài ứng dụng làm phân bón, ammonium chloride còn được sử dụng trong pin với vai trò chất điện li, hay dùng để làm sạch các oxide trên bề mặt kim loại trước khi hàn.
IV. Nguồn gốc một số oxide của nitrogen trong không khí - mưa acid.
1. Nguồn gốc một số oxide của nitrogen.
- Các oxide của nitrogen như NO, NO2 (kí hiệu chung NOx) trong bầu khí quyển được tạo ra từ quá trình tự nhiên (sấm sét) và các hoạt động của con người như đốt cháy nhiên liệu hoá thạch, sản xuất và sử dụng nitric acid…
2. Mưa acid
- Nitrogen monoxide, nitrogen dioxide cùng với sunfur dioxide trong khí quyển là nguyên nhân chính dẫn đến sự có mặt của nitric acid và sulfuric acid hòa tan trong nước mưa.
- Acid trong nước mưa (H2SO4, HNO3) sẽ làm giảm pH của đất và nước, từ đó ảnh hưởng tiêu cực đến cây trồng, thủy sản…Các acid này cũng ăn mòn các kết cấu kim loại, biến đổi thành phần vật liệu của các công trình.
V. Nitric acid
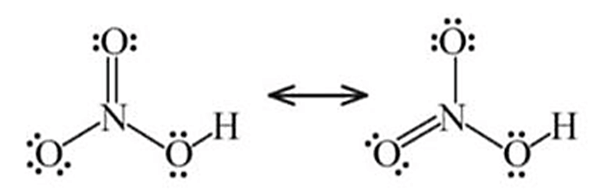
- Công thức Lewis của nitric acid
- Nitric acid là chất lỏng, không màu, có tính acid mạnh và tính oxi hóa mạnh.
- Mỗi năm trên toàn cầu có hàng chục triệu tấn nitric acid được sản xuất. Ứng dụng của nitric acid:
+ Khoảng 80% lượng nitric acid sản xuất mỗi năm được dùng để sản xuất phân đạm.
+ Khoảng 10% lượng nitric acid sản xuất mỗi năm được dùng để oxi hoá các hợp chất hữu cơ trong sản xuất adipic acid, nitrobenzene và thuốc nổ.
+ Ngoài ra, nitric acid được dùng trong các ngành luyện kim, trong các quy trình phân tích mẫu.
VI. Hiện tượng phú dưỡng.
- Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm những hợp chất nitrogen và hợp chất photphorus trong các nguồn nước, do các tác động từ con người.
- Dấu hiệu nhận ra hiện tượng phú dưỡng: xuất hiện dày đặc tảo xanh trong nước.
- Hậu quả: hệ sinh thái của nước bị thay đổi, một lượng lớn bùn tích tụ từ xác của tảo dẫn đến suy kiệt nguồn thuỷ sản.
- Để hạn chế hiện tượng phú dưỡng, cần:
+ Tạo điều kiện để nước trong kênh, rạch, ao, hồ được lưu thông.
+ Xử lí nước thải trước khi cho chảy vào kênh, rạch, ao, hồ.
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm để hạn chế sự rửa trôi của các ion từ nguồn phân bón dư thừa vào kênh, rạch, ao, hồ.