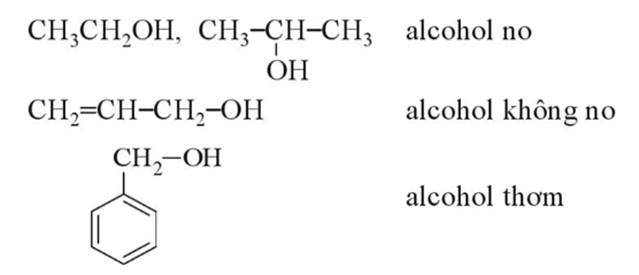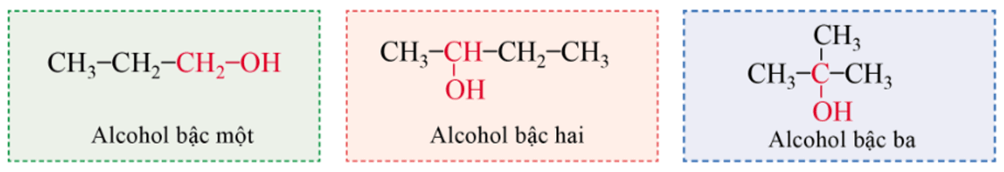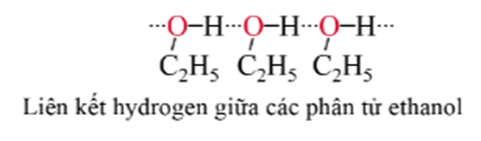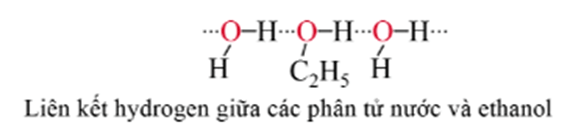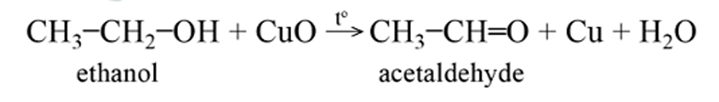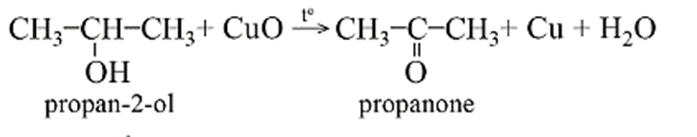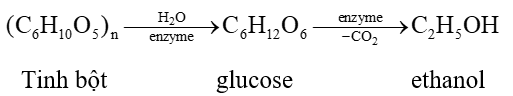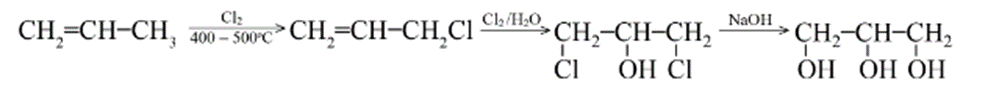Lý thuyết Hóa học 11 Cánh diều Bài 16: Alcohol
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 16: Alcohol sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Cánh diều Bài 16: Alcohol
I. Khái niệm và danh pháp
1. Khái niệm
- Alcohol là những hợp chất hữu cơ trong phân tử có nhóm hydroxy (-OH) liên kết trực tiếp với nguyên tử carbon no.
- Alcohol được phân loại theo nhiều cách khác nhau:
+ Theo gốc hydrocarbon: alcohol được phân thành alcohol no, alcohol không no, alcohol thơm. Ví dụ:
+ Theo số lượng nhóm -OH liên kết với carbon no: alcohol được phân thành alcohol đơn chức (có 1 nhóm – OH) và polyalcohol (hay polyol, có nhiều nhóm – OH).
Ví dụ:
- Ngoài ra alcohol còn được phân loại theo bậc. Bậc của alcohol (bậc một, bậc hai và bậc ba) chính là bậc của nguyên tử carbon no liên kết với nhóm hydroxy. Ví dụ:
- Dãy đồng đẳng của alcohol no, đơn chức, mạch hở có công thức chung là CnH2n+1OH (n ≥ 1).
2. Danh pháp
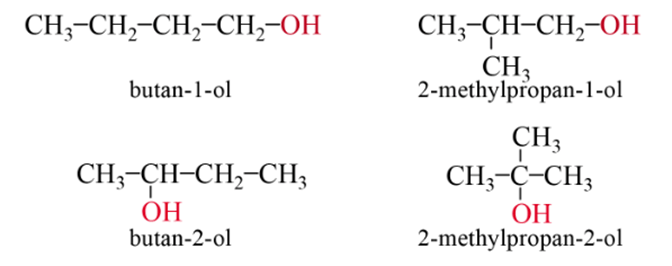
- Tên thay thế:
Bước 1: Chọn mạch carbon chính là mạch dài nhất, có chứa nhóm – OH.
Bước 2: Đánh số mạch chính sao cho vị trí của nguyên tử carbon liên kết với nhóm hydroxy là nhỏ nhất.
Bước 3: Gọi tên.
+ Tên monoalcohol:
Ví dụ:
+ Tên polyalcohol:
Ví dụ:
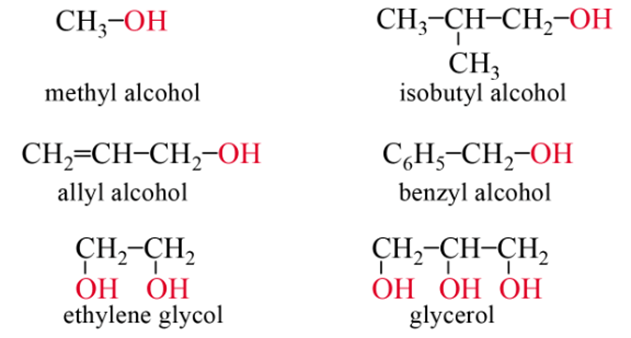
- Tên thông thường:
Một số alcohol có tên thông thường. Ví dụ:
II. Tính chất vật lý
- Do tạo được liên kết hydrogen liên phân tử nên các alcohol có nhiệt độ sôi cao hơn các hydrocarbon hoặc halogen có phân tử khối tương đương.
- Nhiệt độ sôi và khối lượng riêng của các alcohol tăng dần khi phân tử khối tăng.
- Ở điều kiện thường, các alcohol no, đơn chức, mạch hở chứa từ 1-11 nguyên tử carbon là chất lỏng, chứa từ 12 nguyên tử carbon trở lên là chất rắn. Do tạo được liên kết hydrogen với nước, các alcohol từ C1 – C3 tan vô hạn trong nước. Khi số nguyên tử carbon tăng lên thì độ tan của alcohol trong nước giảm dần.
- Các polyalcohol thường sánh, nặng hơn nước và có vị ngọt.
III. Tính chất hóa học
Trong phân tử alcohol liên kết C – OH và liên kết O – H là các liên kết cộng hoá trị phân cực. Do vậy nguyên tử H hoặc nhóm – OH dễ bị tách ra trong các phản ứng hoá học.
1. Phản ứng thế nguyên tử hydrogen trong nhóm –OH
Ví dụ:
2C2H5 –OH + 2Na → C2H5–ONa + H2
2. Phản ứng thế nhóm –OH tạo ether
Ví dụ:
C2H5O–H + HO–C2H5 C2H5OC2H5 + H2O
3. Phản ứng tách H2O tạo alkene
Ví dụ:
H–CH2–CH2–OH CH2=CH2 + H2O
4. Phản ứng oxi hóa
a) Phản ứng oxi hóa hoàn toàn
- Các alcohol cháy, tỏa nhiều nhiệt. Ví dụ:
b) Phản ứng oxi hóa không hoàn toàn
- Alcohol bậc một bị oxi hóa bằng CuO sinh ra aldehyde. Ví dụ:
- Alcohol bậc hai bị oxi hóa sinh ra ketone.
- Alcohol bậc ba không bị oxi hóa.
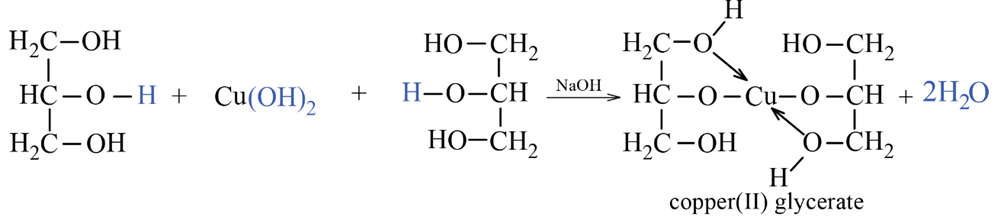
5. Phản ứng riêng của glycerol
- Glyxerol hòa tan được Cu(OH)2 tạo phức chất màu xanh lam, tan được trong nước.
- Các polyalcohol có hai nhóm hydroxy liền kề như ethylene glycol cũng có hòa tan Cu(OH)2 tương tự như glyxerol.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Ethanol được dùng làm nhiên liệu cho đèn cồn trong các phòng thí nghiệm, hoặc pha vào xăng dùng cho động cơ đốt trong; làm dung môi trong pha chế nước hoa, sơn và vecni,…;làm nguyên liệu để tổng hợp các hợp chất hữu cơ khác có nhiều ứng dụng trong công nghiệp và đời sống và được dùng làm chất khử trùng trong y tế và hầu hết các loại gel rửa tay diệt khuẩn hiện nay.
- Methanol được dùng để sản xuất formaldehyde và acetic acid; điều chế methyl amine, methyl chloride…
- Glycerol được dùng làm chất giữ ẩm, chất chống lão hóa, hương vị trong thực phẩm; chất chống đông trong động cơ ô tô…
2. Điều chế
a) Điều chế ethanol
- Ethanol được điều chế phổ biến bằng phương pháp lên men tinh bột hoặc đường:
- Hydrate hóa ethylene:
b) Điều chế glycerol
Một lượng lớn glycerol thu được từ quá trình thuỷ phân chất béo trong quá trình điều chế xà phòng.
Ngoài ra, glycerol còn được tổng hợp từ propene theo sơ đồ sau: