Lý thuyết KHTN 8 Cánh diều Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Khoa học tự nhiên 8 Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh lớp 8 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 8.
Lý thuyết KHTN 8 Cánh diều Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học
I. Phản ứng hoá học là gì?
Phản ứng hoá học là quá trình biến đổi từ chất này thành chất khác.
Chất ban đầu bị biến đổi trong phản ứng được gọi là chất tham gia phản ứng, chất tạo thành sau phản ứng được gọi là chất sản phẩm.
Ví dụ:
Khi đun nóng hỗn hợp bột sắt (iron) và bột lưu huỳnh (sulfur) ta được hợp chất iron(II) sulfide (FeS).
+ Chất tham gia phản ứng là sắt và lưu huỳnh.
+ Chất sản phẩm là iron(II) sulfide.
II. Diễn biến của phản ứng hoá học
- Các biến đổi hoá học xảy ra khi có sự phá vỡ liên kết trong các chất tham gia phản ứng và sự hình thành các liên kết mới để tạo ra chất sản phẩm.
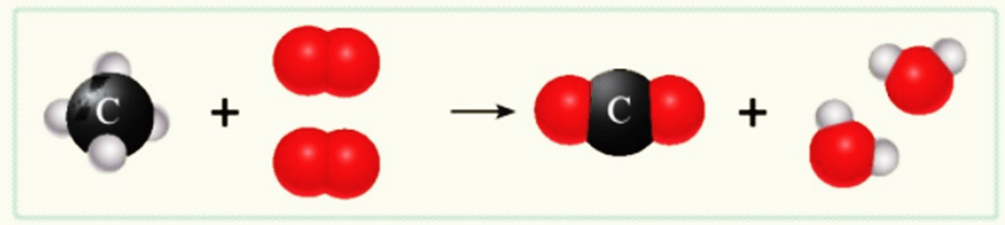
Sơ đồ mô tả phản ứng đốt cháy khí methane trong không khí
thu được carbon dioxide và nước
- Trong phản ứng hoá học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác, kết quả là chất này biến đổi thành chất khác. Số nguyên tử của mỗi nguyên tố trước và sau phản ứng không thay đổi.
III. Dấu hiệu có phản ứng hoá học xảy ra
Để nhận biết có phản ứng hoá học xảy ra có thể dựa vào các dấu hiệu sau:
- Có sự thay đổi màu sắc, mùi, … của các chất; tạo ra chất khí hoặc chất không tan (kết tủa); …
Ví dụ: Trong phản ứng của sắt tác dụng với hydrochloric acid, quan sát thấy có bọt khí bay lên.
- Có sự toả nhiệt và phát sáng
Sự toả nhiệt và phát sáng cũng có thể là dấu hiệu của phản ứng hoá học xảy ra.
Ví dụ: Khi đốt nến, nến cháy có sự toả nhiệt và phát sáng.
IV. Phản ứng toả nhiệt, phản ứng thu nhiệt
1. Khái niệm
Phản ứng hoá học khi xảy ra luôn kèm theo sự toả ra hoặc thu vào năng lượng (thường dưới dạng nhiệt), năng lượng này được gọi là năng lượng của phản ứng hoá học.
+ Phản ứng toả ra năng lượng (dưới dạng nhiệt) được gọi là phản ứng toả nhiệt. Phản ứng toả nhiệt làm nóng môi trường xung quanh.
Ví dụ: Phản ứng đốt cháy than; phản ứng đốt cháy xăng, dầu trong các động cơ; …
+ Phản ứng thu vào năng lượng (dưới dạng nhiệt) được gọi là phản ứng thu nhiệt. Phản ứng thu nhiệt làm lạnh môi trường xung quanh.
Ví dụ: Phản ứng nung vôi (phân huỷ CaCO3 thành CaO và CO2).
2. Ứng dụng của phản ứng toả nhiệt
- Trong sản xuất và đời sống, các phản ứng toả nhiệt có ứng dụng chính là cung cấp năng lượng nhiệt (nhiệt năng) cho các ngành công nghiệp, làm cho các động cơ hay máy phát điện hoạt động.
- Nhiệt năng thu được khi đốt cháy các nhiên liệu như than, xăng, dầu, … có thể được dùng để đun nấu, sưởi ấm, thắp sáng, … Than được sử dụng chủ yếu làm nhiên liệu trong công nghiệp. Xăng, dầu được sử dụng chủ yếu trong vận hành các máy móc, phương tiện giao thông như: xe máy, ô tô, tàu thuỷ, …