Axit nitơric và muối nitrat
Axit nitơric và muối nitrat
A. AXIT NITRIC
I. Cấu tạo phân tử:
- CTPT: HNO3
CTCT: 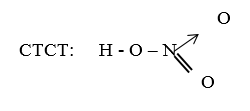
II. Tính chất vật lý
- Là chất lỏng không màu, D = 1.53g/cm3
- Axit nitric không bền, khi có ánh sang phân hủy một phần
4HNO3 → 4NO2 + O2 + 2H2O
- Axit nitric tan vô hạn trong nước.
III. Tính chất hóa học
1. Tính axit: Là một trong số các axit mạnh nhất, trong dung dịch:
HNO3 → H+ + NO3-
- Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit : làm đỏ quỳ tím , tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
2. Tính oxi hóa:
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
a) Với kim loại:
HNO3 oxi hầu hết các kim loại( trừ vàng (Au) và platin(Pt) )
Vd:Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O.
3Cu + 8HNO3(l)→ 3Cu(NO3)2 + 2NO + 4H2O.
+ Fe, Al, Cr bị thụ động hóa trong dung HNO3 đặc nguội.
b) Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi :C, P, S...(trừ N2 và halogen)
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
c) Với hợp chất:
- H2S, Hl, SO2, FeO, muối sắt (II)... có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn. Ví dụ như :
3FeO + 10HNO3(d) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(d) → 3S + 2NO + 4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông... bốc cháy khi tiếp xúc với HNO3 đặc.
V. Điều chế
1-Trong phòng thí nghiệm
NaNO3 (r) + H2SO4 (đ) to→ HNO3 + NaHSO4
Điện phân các muối nitrat của kim loại đứng sau H+ của nước ( sau Al)
M(NO3)x +x/2 H2O đp→ M + x/4 O2 + xHNO3
2- Trong công nghiệp: NH3 → NO → NO2 → HNO3
B. MUỐI NITRAT
I. Tính chất vật lý: Dễ tan trong nước , là chất điện li mạnh trong dung dịch phân ly hoàn toàn thành các ion.
Ca(NO3)2 → Ca2+ + 2NO3-
- Ion NO3- không có
II. Tính chất hóa học:
Các muối nitrat của kim loại kiền và kiềm thổ có môi trường trung tính, muối của kim loại khác có môi trường axit (pH < 7)
1 . Nhiệt phân muối Nitrat
a) Muối nitrat của các kim loaị hoạt động (trước Mg):
Nitrat → Nitrit + O2
vd: 2KNO3 to→ 2KNO2 + O2
b) Muối nitrat của kim loại từ Mg → Cu:
Nitrat → Oxit kim loại + NO2 + O2
vd: 2Cu(NO3)2 to→ 2CuO + 4NO2 + O2
c) Muối của những kim lạo kém hoạt (sau Cu ) :
Nitrat → kim loại + NO2 + O2
vd: 2AgNO3 to→ 2Ag + 2NO2 + O2
2. Ion NO3- trong H+ (axit)
NO3- + 4H+ + 3e → NO + 2H2O
Ví dụ: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
3. Ion NO3- trong OH-(kiềm) : OXH được các kim loại lưỡng tính:
8Al + 3NO3- + 5OH- + 2H2O → 8AlO2- + 3NH3↑
4. Nhận biết ion nitrat (NO3-)
Trong môi trường axit , ion NO3- thể hiện tính oxi hóa giống như HNO3. Do đó thuốc thử dùng để nhận biết ion NO3- là hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng.
Hiện tượng : dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2 NO↑ + 4H2O
2NO + O2 ( không khí) → 2NO2 ( màu nâu đỏ)
Tham khảo các bài Chuyên đề 2 Hóa 11 khác:
- Nitơ
- Amoniac và muối amoni
- Axit nitoric và muối nitrat
- Axit photphoric và muối photphonat
- Phân bón hóa học
- Hiệu suất trong tổng hợp NH3
- Bài tập trắc nghiệm Hiệu suất trong tổng hợp NH3
- Phản ứng tạo phức của NH3
- Bài tập trắc nghiệm Phản ứng tạo phức của NH3
- Phản ứng muối amoni
- Bài tập trắc nghiệm Phản ứng muối amoni
- Kim loại tác dụng với HNO3
- Bài tập trắc nghiệm Kim loại tác dụng với HNO3
- Oxit kim loại tác dụng với HNO3
- Bài tập trắc nghiệm Oxit kim loại tác dụng với HNO3
- Phản ứng NO3- trong môi trường bazơ
- Bài tập trắc nghiệm Phản ứng NO3- trong môi trường bazơ
- Nhiệt phân muối NO3-
- Bài tập trắc nghiệm Nhiệt phân muối NO3-
- Photpho và hợp chất của photpho
- Bài tập trắc nghiệm Photpho và hợp chất của photpho
- Nhận biết một số chất tiêu biểu của nhóm nitơ
- Bài tập trắc nghiệm Nhận biết một số chất tiêu biểu của nhóm nitơ
