Photpho - Axit photphoric - Muối photphonat
Photpho - Axit photphoric - Muối photphonat
I. Photpho
1. Tính chất hóa học
a) Tính oxi hoá: tác dụng với một số kim loại hoạt động, tạo ra photphua kim loại.
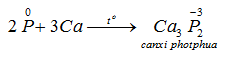
b) Tính khử: tác dụng với các phi kim hoạt động như oxi, halozen, lưu huỳnh ... cũng như với các chất oxi hóa mạnh khác
→ Tác dụng với oxi: Khi đốt nóng, photpho cháy trong không khí tạo ra các oxit của photpho :
Thiếu oxi :
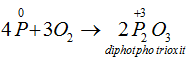
Dư Oxi :
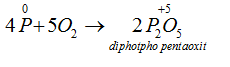
→ Tác dụng với clo: Khi cho clo đi qua P nóng chảy, sẽ thu được các hợp chất photpho clorua:
Thiếu clo :
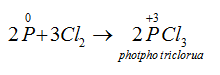
Dư clo :
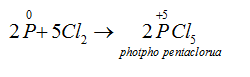
→ Tác dụng với hợp chất:
6P + 5KClO3 → 3P2O5 + 5KCl
2. Điều chế : Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc khoảng 1200oC trong lò điện:
Ca3(PO4)2 + 3SiO2 + 5C to→ 3CaSiO3 + 2P + 5CO (3CaO. P2O5)
Hơi photpho thoát ra được ngưng tụ khi làm lạnh, thu được photpho trắng ở dạng rắn
II. Axit photphoric
Công thức cấu tạo :
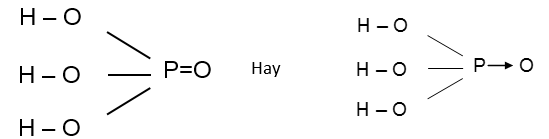
1. Tính chất vật lí: Là chất rắn dạng tinh thể trong suốt, không màu, nóng chảy ở 42,5oC. dễ chảy rữa và tan vô hạn trong nước.
2. Tính chất hóa học:
a) Tính oxi hóa – khử:
Axít photphoric khó bị khử (do P ở mức oxi hóa +5 bền hơn so với N trong axit nitric) , không có tính oxi hóa.
b) Tính axit: Axít photphoric là axit có 3 lần axit, có độ mạnh trung bình. Trong dung dịch nó phân li ra 3 nấc:
H3PO4 ⇌ H+ + H2PO4- k1 = 7, 6.10-3
H2PO4- ⇌ H+ + HPO42- k2 = 6,2.10-8 nấc 1 > nấc 2 > nấc 3
HPO42- ⇌ H+ + PO43- k3 = 4,4.10-13
→ Dung dịch axít photphoric có những tính chất chung của axit như làm quì tím hóa đỏ, tác dụng với oxit bazơ, bazơ, muối, kim loại.
→ Khi tác dụng với oxit bazơ, bazơ tùy theo lượng chất tác dụng mà axít photphoric tạo ra muối trung hòa, muối axit hoặc hỗn hợp muối:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
3. Điều chế :
a) Trong phòng thí nghiệm: P + 5HNO3 →H3PO4 + H2O + 5NO2
b) Trong công nghiệp:
+ Cho H2SO4 đặc tác dụng với quặng photphorit hoặc quặng apatit: Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Điều chế bằng phương pháp này không tinh khiết và lượng chất thấp
+ Để điều chế H3PO4 có độ tinh khiết và nồng độ cao hơn người ta đốt cháy P để được P2O5 rồi cho P2O5 tác dụng với nước :
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
III. Muối photphat
Axít photphoric tạo ra 3 loại muối:
- Muối photphat trung hòa:Na3PO4, Ca3(PO4)2, ...
- Muối đihidrophotphat: NaH2PO4, Ca(H2PO4)2, ...
- Muối hidrophotphat: Na2HPO4, CaHPO4 ...
1.Tính tan: Tất cả các muối đihidrophotphat đều tan trong nước.Các muối hidrophotphat và photphat trung hòa đều không tan hoặc ít tan trong nước ( trừ muối natri, kali, amoni ).
2. Nhận biết ion photphat: Thuốc thử là bạc nitrat.
3Ag+ + PO43- → Ag3PO4 ↓ (màu vàng)
Tham khảo các bài Chuyên đề 2 Hóa 11 khác:
- Nitơ
- Amoniac và muối amoni
- Axit nitoric và muối nitrat
- Axit photphoric và muối photphonat
- Phân bón hóa học
- Hiệu suất trong tổng hợp NH3
- Bài tập trắc nghiệm Hiệu suất trong tổng hợp NH3
- Phản ứng tạo phức của NH3
- Bài tập trắc nghiệm Phản ứng tạo phức của NH3
- Phản ứng muối amoni
- Bài tập trắc nghiệm Phản ứng muối amoni
- Kim loại tác dụng với HNO3
- Bài tập trắc nghiệm Kim loại tác dụng với HNO3
- Oxit kim loại tác dụng với HNO3
- Bài tập trắc nghiệm Oxit kim loại tác dụng với HNO3
- Phản ứng NO3- trong môi trường bazơ
- Bài tập trắc nghiệm Phản ứng NO3- trong môi trường bazơ
- Nhiệt phân muối NO3-
- Bài tập trắc nghiệm Nhiệt phân muối NO3-
- Photpho và hợp chất của photpho
- Bài tập trắc nghiệm Photpho và hợp chất của photpho
- Nhận biết một số chất tiêu biểu của nhóm nitơ
- Bài tập trắc nghiệm Nhận biết một số chất tiêu biểu của nhóm nitơ
