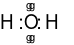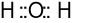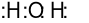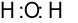Trắc nghiệm Hóa 10 Chương 3 (có đáp án): Liên kết hóa học - Chân trời sáng tạo
Haylamdo biên soạn và sưu tầm 50 bài tập trắc nghiệm Hóa 10 Chương 3: Liên kết hóa học sách Chân trời sáng tạo có đáp án và lời giải chi tiết đầy đủ các mức độ sẽ giúp học sinh ôn luyện trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa 10 Chương 3 (có đáp án): Liên kết hóa học - Chân trời sáng tạo
Trắc nghiệm Hóa học 10 Bài 11: Liên kết hydrogen và tương tác van der waals
Câu 1:
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
A. 8 electron tương ứng với khí hiếm gần nhất
B. 2 electron tương ứng với kim loại gần nhất
C. 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium)
D. 6 electron tương ứng với phi kim gần nhất
Câu 2:
Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Câu 3:
Mô tả sự hình thành ion của nguyên tử Mg (Z = 12) theo quy tắc octet là
Câu 4:
Nguyên tử có cấu hình electron bền vững là
A. Na (Z = 11)
B. Cl (Z = 17)
C. Ne (Z = 10)
D. O (Z = 8)
Câu 5:
Mô tả sự hình thành ion của nguyên tử S (Z = 16) theo quy tắc octet là
Câu 6:
Để đạt được quy tắc octet, nguyên tử potassium (Z= 19) phải nhường điA. 2 electron
B. 1 electron
C. 3 electron
D. 4 electron
Câu 7:
Để đạt được quy tắc octet, nguyên tử nitrogen (Z= 7) phải nhận thêm
A. 2 electron
B. 1 electron
C. 3 electron
D. 4 electron
Câu 9:
Ion aluminium có cấu hình electron của khí hiếm tương ứng nào
A. He
B. Ne
C. Ar
D. Kr
Câu 10:
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Helium
B. Fluorine
C. Aluminium
D. Sodium
Câu 11:
Nguyên tử nguyên tố nào sau đây có xu hướng nhận thêm 2 electron khi hình thành liên kết hóa học?
A. Oxide
B. Neon
C. Carbon
D. Magnesium
Câu 12:
Nguyên tử X có điện tích hạt nhân là +20. Khi hình thành liên kết hóa học X có xu hướng
A. nhường 8 electron
B. nhận 6 electron
C. nhận 2 electron
D. nhường 2 electron
Câu 13:
Nguyên tử Y có 15 proton. Khi hình thành liên kết hóa học Y có xu hướng hình thành ion có cấu hình electron là
A. 1s22s22p63s23p3
B. 1s22s22p63s23p6
C. 1s22s22p6
D. 1s22s22p63s23p64s2
Câu 14:
Nguyên tử X có 9 electron. Ion được tạo thành từ X theo quy tắc octet có số electron là
A. 8 electron
B. 9 electron
C. 10 electron
D. 12 electron
Câu 15:
Nguyên tử Y có 7 electron. Ion được tạo thành từ Y theo quy tắc octet có số electron, proton lần lượt là
A. 8 electron; 8 proton
B. 7 electron; 7 proton
C. 10 electron; 10 proton
D. 10 electron; 7 proton
Câu 1:
Khẳng định đúng là
A. Khi nhường electron, nguyên tử trở thành ion dương (cation)
B. Khi nhận electron, nguyên tử trở thành ion âm (anion)
C. Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận
D. Cả A, B và C đều đúng.
Câu 2:
Liên kết ion thường được hình thành khi
A. kim loại điển hình tác dụng với phi kim điển hình
B. 2 phi kim điển hình tác dụng với nhau
C. kim loại điển hình tác dụng với khí hiếm
D. phi kim điển hình tác dụng với khí hiếm
Câu 3:
Liên kết ion trong hợp chất KCl tạo bởi lực hút tĩnh điện giữa
A. cation K2+ và anion Cl2−
Câu 4:
Phát biểu nào sau đây là đúng?
A. Liên kết ion chỉ có trong đơn chất
B. Liên kết ion chỉ có trong hợp chất
C. Liên kết ion có cả trong đơn chất và hợp chất
D. Cả A, B, và C đều sai.
Câu 5:
Quá trình hình thành liên kết ion trong phân tử MgO là
A. Mg ⟶ Mg2++ 2e; O + 2e ⟶ O2−; Mg2+ + O2−⟶ MgO
B. Mg ⟶ Mg++ 1e; O + 1e ⟶ O−; Mg+ + O−⟶ MgO
C. O ⟶ O2++ 2e; Mg + 2e ⟶ Mg2−; O2+ + Mg2−⟶ MgO
D. O ⟶ O++ 1e; Mg + 1e ⟶ Mg−; O+ + Mg−⟶ MgO
Câu 6:
Quá trình hình thành liên kết ion trong phân tử CaCl2 là
A. Ca ⟶ Ca2++ 2e; Cl + 2e ⟶ Cl2−; Ca2+ + Cl2−⟶ CaCl2
B. Ca ⟶ Ca2++ 2e; Cl + 1e ⟶ Cl−; Ca2+ + Cl−⟶ CaCl2
C. Ca ⟶ Ca2++ 2e; Cl + 1e ⟶ Cl−; Ca2+ + 2Cl−⟶ CaCl2
D. Ca ⟶ Ca++ 1e; Cl + 2e ⟶ Cl2−; Ca+ + Cl2−⟶ CaCl2
Câu 7:
Ion Al3+có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Câu 8:
Cho các ion sau: Ca2+, F−, Al3+và P3−. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
Câu 9:
So sánh nào dưới đây là đúng?
A. Bán kính nguyên tử Ca bằng bán kính ion Ca2+
B. Bán kính nguyên tử Ca lớn hơn bán kính ion Ca2+
C. Bán kính nguyên tử Ca nhỏ hơn bán kính ion Ca2+
D. Bán kính nguyên tử Ca lớn hơn hoặc bằng bán kính ion Ca2+
Câu 11:
Cho các tính chất dưới đây:
(i) Dẫn điện ở trạng thái rắn.
(ii) Dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện.
(iii) Thường tồn tại ở thể rắn trong điều kiện thường.
(iiii) Dễ nóng chảy, dễ bay hơi.
Số tính chất điển hình đúng của hợp chất ion là
A. 1
B. 2
C. 3
D. 4
Câu 12:
Anion X3- có cấu hình electron 1s22s22p63s23p6. Cấu hình electron nguyên tử của X là
A. 1s22s22p63s23p3
B. 1s22s22p63s23p6
C. 1s22s22p63s23p63d14s2
D. 1s22s22p6
Câu 13:
Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng
A. chất lỏng
B. chất khí
C. tinh thể rắn
D. rắn, lỏng hoặc khí
Câu 14:
Liên kết ion là loại liên kết phổ biến trong
A. các hợp chất được tạo nên từ kim loại điển hình và phi kim điển hình
B. các hợp chất được tạo nên từ 2 phi kim điển hình
C. các hợp chất được tạo nên từ 2 kim loại điển hình
D. các đơn chất
Câu 15:
Công thức của hợp chất ion được hình thành từ anion Y2− và cation X+ là
A. XY
B. X2Y2
C. X2Y
D. XY2
Câu 1:
Liên kết cộng hóa trị là liên kết hình thành giữa hai nguyên tử bằng
A. lực hút tĩnh điện giữa các ion mang điện tích trái dấu
B. một cặp electron chung
C. một hay nhiều cặp electron chung
D. các electron hóa trị riêng
Câu 2:
Liên kết giữa hai nguyên tử được hình thành bởi một cặp electron chung được gọi là
A. liên kết bội
B. liên kết đơn
C. liên kết đôi
D. liên kết ba
Câu 3:
Dựa vào số cặp electron chung, liên kết cộng hóa trị được chia thành mấy loại?
A. 2 loại: liên kết σ và liên kết π
B. 2 loại: liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực
C. 3 loại: liên kết đơn, liên kết đôi và liên kết ba
D. 2 loại: liên kết đơn và liên kết đôi
Câu 4:
Liên kết cộng hóa trị được chia thành liên kết cộng hóa trị không phân cực và phân cực dựa vào
A. số cặp electron chung
B. sự xen phủ các orbital
C. vị trí của các cặp electron chung
D. vị trí của các electron hóa trị riêng
Câu 5:
Trong phân tử N2, mỗi nguyên tử N đã góp 3 electron để tạo cặp electron chung. Nhờ đó mỗi nguyên tử N đã đạt cấu hình electron bền vững của khí hiếm
A. Xe
B. Ne
C. Ar
D. Kr
Câu 6:
Cho công thức Lewis của phân tử NH3dưới đây. Số electron dùng chung của N là

A. 2 electron dùng chung
B. 3 electron dùng chung
C. 6 electron dùng chung
D. 5 electron dùng chung
Câu 7:
Công thức biểu diễn cấu tạo nguyên tử qua các liên kết và các electron hóa trị riêng là
A. công thức phân tử
B. công thức electron
C. công thức Lewis
D. công thức đơn giản nhất
Câu 11:
Dựa vào giá trị độ âm điện, liên kết giữa nguyên tử H và Cl thuộc loại
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết đơn
Câu 12:
Dựa vào độ âm điện, liên kết trong phân tử nào dưới đây là liên kết cộng hóa trị không cực?
A. NaCl
B. CH4
C. H2O
D. HCl
Câu 13:
Khẳng định sai là
A. Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết σ
B. Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi π
C. Liên kết đơn còn gọi là liên kết π
D. Liên kết đôi gồm một liên kết σ và một liên kết π, liên kết ba gồm một liên kết σ và hai liên kết π
Câu 14:
Các AO xen phủ tạo liên kết đơn trong phân tử Cl2là
A. 2 AO s xen phủ trục tạo liên kết đơn
B. 1 AO s và 1 AO p xen phủ trục tạo liên kết đơn
C. 2 AO p xen phủ trục tạo liên kết đơn
D. 2 AO ps xen phủ bên tạo liên kết đơn
Câu 15:
Cho các phân tử HF, HBr, HI, HCl. Sắp xếp theo chiều tăng dần độ bền liên kết là
A. HF, HBr, HI, HCl
B. HI, HBr, HCl, HF
C. HF, HCl, HBr, HI
D. HBr, HI, HF, HCl
Câu 1:
Loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác (có độ âm điện lớn thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết là
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết hydrogen
Câu 2:
H2O có nhiệt độ sôi cao hơn H2S là vì
A. H2O có kích thước phân tử nhỏ hơn H2S
B. H2O có khối lượng phân tử nhỏ hơn H2S
C. Giữa các phân tử H2O có liên kết hydrogen
D. Cả A, B và C đều sai
Câu 3:
Một phân tử nước có thể tạo liên kết hydrogen tối đa với bao nhiêu phân tử nước khác?
A. 1
B. 2
C. 3
D. 4
Câu 4:
Giữa các phân tử C2H5OH
A. không tồn tại liên kết hydrogen
B. tồn tại liên kết hydrogen giữa nguyên tử H (liên kết với C) và nguyên tử O
C. tồn tại liên kết hydrogen giữa nguyên tử H (liên kết với O) và nguyên tử O
D. tồn tại liên kết hydrogen giữa nguyên tử H (liên kết với O) và nguyên tử C
Câu 5:
Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại số loại liên kết hydrogen là
A. 1
B. 2
C. 3
D. 4
Câu 6:
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. CH4
B. NH3
C. PH3
D. H2S
Câu 7:
Khẳng định đúng là
A. NH3 có độ tan trong nước lớn hơn PH3
B. NH3 có độ tan trong nước thấp hơn PH3
C. NH3 có độ tan trong nước tương tự PH3
D. Cả A, B và C đều sai.
Câu 8:
Trong phân tử, khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các
A. lưỡng cực tạm thời
B. lưỡng cực cảm ứng
C. lưỡng cực vĩnh viễn
D. một ion âm
Câu 9:
Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các
A. ion âm và ion dương
B. lưỡng cực tạm thời
C. lưỡng cực cảm ứng
D. Cả B và C.
Câu 10:
Tương tác van der Waals làm
A. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất
B. giảm nhiệt độ nóng chảy và tăng nhiệt độ sôi của các chất
C. tăng nhiệt độ nóng chảy và giảm nhiệt độ sôi của các chất
D. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
Câu 11:
Bản chất hình thành liên kết hydrogen và tương tác van der waals đều do
A. sự góp chung electron
B. sự nhường – nhận electron
C. tương tác hút tĩnh điện
D. Cả A, B và C đều sai
Câu 13:
Tương tác van der Waals tăng khi
A. khối lượng phân tử tăng, kích thước phân tử tăng
B. khối lượng phân tử giảm, kích thước phân tử giảm
C. khối lượng phân tử tăng, kích thước phân tử giảm
D. khối lượng phân tử giảm, kích thước phân tử tăng
Câu 14:
HF có nhiệt độ sôi cao hơn HBr là vì
A. Khối lượng phân tử của HF nhỏ hơn HBr
B. Năng lượng liên kết H – F lớn hơn H – Br
C. Giữa các phân tử HF có liên kết hydrogen còn HBr thì không
D. Cả A, B và C đều sai
Câu 15:
Liên kết hydrogen ảnh hưởng tới tính chất của nước như
A. đặc điểm tập hợp
B. nhiệt độ nóng chảy
C. nhiệt độ sôi
D. Cả A, B và C