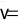Trắc nghiệm Hóa 10 Chương 6 (có đáp án): Tốc độ phản ứng hóa học - Chân trời sáng tạo
Haylamdo biên soạn và sưu tầm 20 bài tập trắc nghiệm Hóa 10 Chương 6: Tốc độ phản ứng hóa học sách Chân trời sáng tạo có đáp án và lời giải chi tiết đầy đủ các mức độ sẽ giúp học sinh ôn luyện trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa 10 Chương 6 (có đáp án): Tốc độ phản ứng hóa học - Chân trời sáng tạo
Trắc nghiệm Hóa học 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Trắc nghiệm Hóa học 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Câu 1:
Tốc độ phản ứng của một phản ứng hóa học là
A. đại lượng đặc trưng cho sự biến thiên nồng độ của chất phản ứng trong một đơn vị thời gian;
B. đại lượng đặc trưng cho sự biến thiên nồng độ của chất sản phẩm trong một đơn vị thời gian;
C. đại lượng đặc trưng cho sự biến thiên tốc độ chuyển động của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian;
D. đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian,
Câu 2:
Kí hiệu và đơn vị của tốc độ phản ứng là
A. kí hiệu là 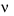 , đơn vị là (đơn vị nồng độ) / đơn vị thời gian;
, đơn vị là (đơn vị nồng độ) / đơn vị thời gian;
B. kí hiệu là  , đơn vị là (đơn vị khối lượng) / đơn vị thời gian;
, đơn vị là (đơn vị khối lượng) / đơn vị thời gian;
C. kí hiệu là 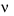 , đơn vị là (đơn vị nồng độ) / đơn vị thể tích;
, đơn vị là (đơn vị nồng độ) / đơn vị thể tích;
D. kí hiệu là  , đơn vị là (đơn vị khối lượng) / đơn vị thể tích.
, đơn vị là (đơn vị khối lượng) / đơn vị thể tích.
Câu 4:
Cho phản ứng ở 45°C
2N2O5 (g) ⟶ O2 (g) + 2N2O4 (g)
Sau 275 giây đầu tiên, nồng độ của O2 là 0,188 M. Tính tốc độ trung bình của phản ứng theo O2 trong khoảng thời gian trên.
A. 1463 M / giây;
B. 6,8.10−4 M / giây;
C. 8,6.10−4 M / giây;
D. 6,8.104 M / giây.
Câu 5:
Cho phản ứng:
2N2O5 (g) ⟶ O2 (g) + 4NO2 (g)
Sau thời gian từ giây 57 đến giây 116, nồng độ N2O5 giảm từ 0,4 M về 0,35 M. Tốc độ trung bình của phản ứng trong khoảng thời gian trên là
A. 8,48.10−4 M / giây;
B. 4,42.10−4 M / giây;
C. 8,84.10−4 M / giây;
D. 4,24.10−4 M / giây.
Câu 6:
Cho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức
A. 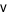 =
= 
B. 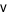 =
= 
C. 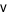 =
= 
D. 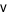 =
= 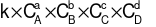
Câu 7:
Cho phản ứng: 2SO2 (g) + O2 (g) 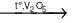 2SO3 (g)
2SO3 (g)
Biểu thức tốc độ thức thời của phản ứng theo định luật tác dụng khối lượng là
A. 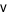 =
= 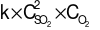
B. 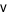 =
= 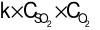
C. 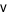 =
= 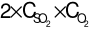
D. 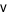 =
= 
Câu 8:
Hằng số tốc độ phản ứng k chỉ phụ thuộc vào
A. bản chất của phản ứng;
B. nồng độ các chất;
C. nhiệt độ;
D. Cả A và C.
Câu 9:
Hằng số tốc độ phản ứng k bằng vận tốc tức thời 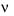 khi
khi
A. nồng độ chất phản ứng bằng đơn vị (1 M);
B. nhiệt độ ở 0°C;
C. nhiệt độ ở 25°C;
D. Hằng số tốc độ phản ứng k không thể bằng vận tốc tức thời 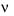 .
.
Câu 10:
Cho phản ứng đơn giản xảy ra trong bình kín: 2CO (g) + O2 (g) ⟶ 2CO2 (g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 2 lần, nồng độ O2 không đổi.
A. tăng gấp 4 lần
B. tăng gấp 8 lần
C. không thay đổi
D. giảm 2 lần
Câu 11:
Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 3 lần.
A. tăng 3 lần;
B. tăng 6 lần;
C. tăng 9 lần;
D. tăng 81 lần.
Câu 12:
Cho phản ứng đơn giản xảy ra trong bình kín: H2(g) + Cl2 (g) ⟶ 2HCl (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần.
A. tăng 4 lần;
B. giảm 4 lần;
C. giảm 2 lần;
D. tăng 8 lần.
Câu 13:
Cho phản ứng: Br2 (l) + HCOOH (aq) 2HBr (aq) + CO2 (s)
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản ứng trên là 4.10-5M/s. Giá trị của a là
A. 0,02 M;
B. 0,07 M;
C. 0,02 M;
D. 0,022 M.
Câu 14:
Cho phản ứng: 2H2O2 (aq) O2 (s) +2H2O (l)
O2 (s) +2H2O (l)
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10−4 M/s;
B. 5.10−4 M/s;
C. 1,5.10−4 M/s;
D. 3.10−4 M/s.
Câu 15:
Hiện tượng nào dưới đây xảy ra với tốc độ nhanh nhất?
A. Nướng bánh;
B. Lên men sữa chua tạo sữa chua;
C. Đốt gas khi nấu ăn;
D. Cánh cổng sắt bị gỉ sét.
Câu 1:
Tốc độ phản ứng phụ thuộc vào các yếu tố
A. nồng độ, áp suất
B. nhiệt độ
C. chất xúc tác, diện tích bề mặt
D. Cả A, B và C
Câu 2:
Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức
A.  =
= 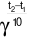
B.  =
= 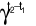
C.  =
= 
D.  =
= 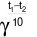
Câu 3:
Kết luận nào sau đây sai?
A. Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng;
B. Khi tăng nhiệt độ, tốc độ phản ứng tăng;
C. Đối với tất cả các phản ứng, tốc độ phản ứng tăng khi áp suất tăng;
D. Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
Câu 4:
Chất làm tăng tốc độ phản ứng hóa học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng là
A. chất xúc tác;
B. chất ban đầu;
C. chất sản phẩm;
D. Cả A, B và C đều sai.
Câu 5:
Khi đốt than trong lò, đậy nắp lò sẽ giữ than cháy được lâu hơn.
Yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng trong ví dụ trên là
A. nhiệt độ;
B. nồng độ;
C. chất xúc tác;
D. diện tích bề mặt tiếp xúc.
Câu 6:
Hiện tượng nào dưới đây thể hiện ảnh hưởng của nhiệt độ đến tốc độ phản ứng?
A. Thanh củi được chẻ nhỏ hơn thì sẽ cháy nhanh hơn;
B. Quạt gió vào bếp than để thanh cháy nhanh hơn;
C. Thức ăn lâu bị ôi thiu hơn khi để trong tủ lạnh;
D. Các enzyme làm thúc đẩy các phản ứng sinh hóa trong cơ thể.
Câu 7:
Cho phản ứng: 2CO (g) + O2 (g) ⟶ 2CO2 (g)
Với hệ số nhiệt độ Van’t Hoff 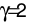 . Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
. Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
A. tăng gấp 2 lần;
B. tăng gấp 8 lần;
C. giảm 4 lần;
D. tăng gấp 6 lần.
Câu 8:
Cho hiện tượng sau: Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất.
Hiện tượng trên thể hiện ảnh hưởng của yếu tố nào đến tốc độ phản ứng?
A. Nồng độ;
B. Nhiệt độ;
C. Diện tích bề mặt tiếp xúc;
D. Chất xúc tác.
Câu 9:
Người ta vận dụng yếu tố nào để tăng tốc độ phản ứng trong trường hợp sau: Nung hỗn hợp bột đá vôi, đất sét và thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất xi măng.
A. Nồng độ;
B. Nhiệt độ;
C. Áp suất;
D. Chất xúc tác.
Câu 10:
Phản ứng trong thí nghiệm nào dưới đây có tốc độ lớn nhất?
A. a gam Zn (hạt) + dung dịch HCl 0,2M ở 30°C;
B. a gam Zn (bột) + dung dịch HCl 0,2M ở 30°C;
C. a gam Zn (hạt) + dung dịch HCl 0,2M ở 40°C;
D. a gam Zn (bột) + dung dịch HCl 0,2M ở 40°C.
Câu 11:
Hệ số nhiệt độ Van’t Hoff của một phản ứng là 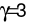 . Tốc độ phản ứng thay đổi như thế nào khi giảm nhiệt độ phản ứng từ 80°C về 60°C?
. Tốc độ phản ứng thay đổi như thế nào khi giảm nhiệt độ phản ứng từ 80°C về 60°C?
A. giảm 9 lần;
B. tăng 3 lần;
C. giảm 6 lần;
D. tăng 9 lần.
Câu 12:
Phát biểu nào sau đây sai?
A. Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn;
B. Áp suất của các chất khí tham gia phản ứng càng lớn, tốc độ phản ứng càng lớn;
C. Diện tích bề mặt càng nhỏ, tốc độ phản ứng càng lớn;
D. Nhiệt độ càng cao, tốc độ phản ứng càng lớn.
Câu 13:
Cho phản ứng sau: 2KMnO4 (s) → K2MnO4 (s) + MnO2 (s) + O2 (g). Yếu tố không ảnh hưởng đến tốc độ của phản ứng này là:
A. Nhiệt độ;
B. Kích thước KMnO4 (s);
C. Áp suất;
D. Cả A, B và C.
Câu 14:
Người ta sử dụng phương pháp nào để tăng tốc độ phản ứng trong trường hợp sau: Nén hỗn hợp khí N2 và H2 ở áp suất cao để tổng hợp NH3.
A. Tăng nhiệt độ;
B. Tăng áp suất;
C. Tăng thể tích;
D. Tăng diện tích bề mặt tiếp xúc.
Câu 15:
Thí nghiệm cho 7 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 3M ở nhiệt độ thường. Tác động nào sau đây không làm tăng tốc độ của phản ứng?
A. Thay 7 gam kẽm hạt bằng 7 gam kẽm bột;
B. Dùng dung dịch H2SO4 4M thay dung dịch H2SO4 3M;
C. Tiến hành ở 40°C;
D. Làm lạnh hỗn hợp