Lý thuyết Hóa học 8 Bài 22: Tính theo phương trình hóa học hay, chi tiết
Lý thuyết Hóa học 8 Bài 22: Tính theo phương trình hóa học hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 8 Bài 22: Tính theo phương trình hóa học hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 8.

1. Tìm khối lượng chất tham gia và chất sản phẩm
Cách làm:
- Bước 1: Viết phương trình
- Bước 2: tính số mol các chất
- Bước 3: dựa vào phương trình tính được số mol chất cần tìm
- Bước 4: tính khối lượng
Thí dụ 1: cho 4g NaOH tác dụng với CuSO4 tạo ra Cu(OH)2 kết tủa và Na2SO4. Tính khối lượng Na2SO4
Các bước tiến hành
- Viết PTHH và cân bằng
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Tính số mol NaOH tham gia phản ứng
nNaOH = 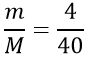
Tính số mol Na2SO4 thu được
Theo PTHH: 1 mol NaOH phản ứng thu được 0,5 mol Na2SO4
Vậy: 0,1 mol NaOH…………………0,05 mol Na2SO4
Tìm khối lương Na2SO4 thu được
mNa2SO4 = n×M = 0,05×142 = 7,1g
Thí dụ 2: Tính khối lương NaOH cần dùng để điều chế 7,1g Na2SO4
Viết PTHH:
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Tính số mol Na2SO4 sinh ra sau phản ứng
nNa2SO4 = 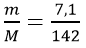
Tìm số mol NaOH tham gia phản ứng
Theo PTHH: để điều chế 1 mol Na2SO4 cần dùng 2 mol NaOH
Vậy muốn điều chế 0,05 mol Na2SO4 cần dùng 0,1 mol NaOH
Tính khối lương NaOH cần dùng
mNaOH = n×M = 0,1×40 = 4(g)
2. Tìm thể tích chất khí tham gia và sản phẩm
Cách làm:
- Bước 1: Viết PTHH
- Bước 2: Tìm số mol khí
- Bước 3: thông qua PTHH, tìm số mol chất cần tính
- Bước 4: Tìm thể tích khí
Thí dụ 1: Lưu huỳnh cháy trong oxi hoặc trong không khí sinh ra lưu huỳnh đioxit SO2. Hãy tính thể tích (đktc) sinh ra, nếu có 4g khí O2 tham gia phản ứng
- Viết PTHH
S + O2 −to→ SO2
- Tìm số mol O2 sinh ra sau phản ứng:
nO2 = 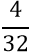
- Tìm số mol SO2 sinh ra sau phản ứng
Theo PTHH: 1 mol O2 tham gia phản ứng sinh ra 1 mol SO2
Vậy : 0,125 mol O2 …………………………. 0,125 mol SO2
- Tìm thể tích khí SO2(đktc) sinh ra sau phản ứng
VSO2 = n.22,4 = 0,125.2,24 = 2,8 lít
Thí dụ 2: tìm thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 64g lưu huỳnh
- Viết PTHH:
S + O2 −to→ SO2
- Tính số mol lưu huỳnh tham gia phản ứng
nS = 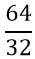
- Tính số mol O2 tham gia phản ứng
Theo PTHH: đốt cháy 1 mol S cần dùng 1 mol O2
Vậy : đốt cháy 2 mol S cần 2 mol O2
- Tính thể tích O2 cần dùng:
VO2 = 22,4 × n = 44,8 (l)
Bài tập tự luyện
Bài 1: Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng: – Khí A có tỉ lệ khối đối với không khí là 0,552 – Thành phần theo khối lượng của khí A là: 75% C và 25% H Các thể tích khí đo ở đktc
A. 11,2 lít.
B. 6,72 lít.
C. 22,4 lít.
D. 15,68 lít.
Lời giải:
Khối lượng mol khí A tham gia phản ứng là:
dA/kk = 0,552 => MA = 29 . 0,552 = 16 gam
mC = ![]() = 12 ; mH =
= 12 ; mH = ![]() = 4
= 4
Đặt công thức hóa học của khí A là CxHy, ta có:
12 . x = 12 => x = 1
1 . y = 4 => y = 4
Công thức hóa học của khí A là CH4
Phương trình phản ứng : CH4 + 2O2![]() CO2 + 2H2O
CO2 + 2H2O
Theo phương trình phản ứng, thể tích oxi bằng hai lần thể tích khí CH4 nên thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A là:
VO2=2.VCH4VO2=2.VCH4 = 11,2 . 2 = 22,4 lít
Đáp án cần chọn là: C
Bài 2:
A,Biết rằng 2,3 gam một kim loại R (có hoá trị I) tác dụng vừa đủ với 1,12 lít khí clo (ở đktc) theo sơ đồ phản ứng:
R + Cl2![]() RCl
RCl
Kim loại R là:
A. K
B. Li
C. Cu
D. Na
Lời giải:
Số mol Cl2 cần dùng là: nCl2= ![]() =
= ![]() = 0,05 mol
= 0,05 mol
PTHH: 2R + Cl2![]() 2RCl
2RCl
Tỉ lệ theo PT: 2mol 1mol 2 mol
?mol 0,05mol
Từ PTHH, ta có: nR=2.nCl2=2.0,05=0,1 mol
=> Khối lượng mol nguyên tử của R là:
MR= ![]() =
=![]() =23g/mol
=23g/mol
=> R là natri (Na)
Đáp án cần chọn là: D
B, Biết rằng 2,3 gam một kim loại R (có hoá trị I) tác dụng vừa đủ với 1,12 lít khí clo (ở đktc) theo sơ đồ phản ứng: R + Cl2![]() RCl
RCl
A. 5,85 gam.
B. 11,7 gam.
C. 7,02 gam.
D. 8,19 gam.
Cách 1:
PTHH: 2Na + Cl2![]() 2NaCl
2NaCl
Theo pt: 2mol 1mol 2mol
0,05mol ?mol
Từ PTHH, ta có: nNaCl=2nCl2=2.0,05=0,1 mol
=> khối lượng của sản phẩm là: mNaCl = n.M = 0,1.58,5 = 5,85 gam
Cách 2: Theo định luật bảo toàn khối lượng:
mNaCl=mNa+mCl2 = 2,3+0,05.71=5,85 gam
Đáp án cần chọn là: A
Bài 3: Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách nhiệt phân kali clorat theo sơ đồ phản ứng: KClO3![]() KCl + O2
KCl + O2
A. 24,5 gam.
B. 12,25 gam.
C. 36,75 gam.
D. 49,0 gam.
Lời giải:
Số mol O2 thu được là: nO2= 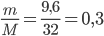
PTHH: 2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
Tỉ lệ theo PT: 2 mol 2 mol 3 mol
?mol ?mol 0,3 mol
Từ PTHH, ta có: nKClO3=23. nO2=23.0,3=0,2 mol
=> Khối lượng của KClO3 cần dùng là:mKClO3= n . M = 0,2.122,5 = 24,5 gam
Đáp án cần chọn là: A
Bài 4: Cho phương trình hóa học sau: CaCO3 ![]() CaO + CO2
CaO + CO2
A. 0,1 mol.
B. 0,3 mol.
C. 0,2 mol.
D. 0,4 mol.
Lời giải:
Số mol CaO là : nCaO= ![]() =0,2 mol
=0,2 mol
PTHH: CaCO3 to CaO + CO2
Tỉ lệ theo PT: 1mol 1mol
?mol 0,2mol
Từ PTHH, ta có: nCaCO3=nCaO=0,2 mol
Vậy cần dùng 0,2 mol CaCO3 để điều chế CaO
Đáp án cần chọn là: C
Bài 5: Khử 48 gam đồng (II) oxit bằng hiđro được 36,48 gam đồng sau phản ứng. Hiệu suất của phản ứng trên là:
A. 95%.
B. 90%.
C. 94%.
D. 85%.
Lời giải:
CuO + H2![]() Cu + H2O
Cu + H2O
nCu = 36,48 /64 = 0,57 (mol)
nCuO = 48/ 80 = 0,6 (mol)
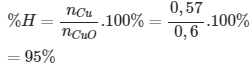
Đáp án cần chọn là: A

