Lý thuyết Hóa học 8 Bài 37: Axit - Bazơ - Muối hay, chi tiết
Lý thuyết Hóa học 8 Bài 37: Axit - Bazơ - Muối hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 8 Bài 37: Axit - Bazơ - Muối hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 8.

1. Axit
a. Khái niệm
Phân tử axit gồm có một hay nhiều nguyên tử hihdro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại
b. CTHH: gồm một hay nhiều nguyên tử H và gốc axit
c. Phân loại: 2 loại
- Axit không có oxi: HCl, H2S,….
- Axit có oxi: H2SO4, H2CO3,…
d. Tên gọi
- Axit không có oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Gốc axit tương ứng là clorua
H2S: axit sunfuhidric. Gốc axit tương ứng là sunfua
- Axit có oxi
+ Axit có nhiều oxi:
Tên axit = axit + tên phi kim + ic
VD: H2SO4 : axit sunfuric. Gốc axit: sunfat
HNO3: axit nitric. Gốc axit: nitrat
+ Axit có ít oxi:
Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Gốc axit sunfit
2. Bazơ
a. Khai niệm:
Phân tử bazo gồm có môt nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n , n: số hóa trị của kim loại
c. Tên gọi:
Tên bazo = tên kim loại ( kèm hóa trị nếu có nhiều hóa trị) + hidroxit
VD: Fe(OH)2: sắt (II) hidroxit
KOH: kali hidroxit
d. Phân loại
Bazơ tan trong nước gọi là kiềm. VD: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không tan trong nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối có một hay nhiều nguyên tử kim loại liên kết với môht hay nhiều gốc axit
b. CTHH: gồm 2 phần: kim loại và gốc axit
VD: Na2SO4, CaCO3,…
c. Tên gọi
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4 : natri sunfat
CaCO3: canxi cacbonat
FeSO4: sắt (II) sunfat
d. Phân loại
- Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hidro có thể thay thế bằng các nguyên tử kim loại
VD: Na2SO4, CaCO3,…
- Muối axit: là muối trong đó gốc axit còn nguyên tử hidro H chưa được thay thế bằng nguyên tử kim loại. Hóa trị của gốc axit bằng số nguyên tử hidro đã được thay thế bằng các nguyên tử kim loại.
VD: NaHSO4, NaHS, NaHSO3,…
Bài tập tự luyện
Bài 1: Oxit tương ứng với axit H2SO3 làA. SO2.
B. SO3.
C. SO.
D. CO2.
Lời giải:
Oxit tương ứng với axit H2SO3 là SO2
Đáp án cần chọn là: A
Bài 2: Cho các chất sau: H2SO4, HCl, NaCl, CuSO4, NaOH, Mg(OH)2. Số chất thuộc loại axit là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Các chất thuộc loại axit là: H2SO4, HCl →→ có 2 chất
Đáp án cần chọn là: B
Bài 3: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành xanh?
A. NaOH, BaCl2, H3PO4, KOH.
B. NaOH, Na2SO4, KCl, KOH.
C. NaOH, Ba(OH)2, Ca(OH)2, KOH.
D. NaOH, Ca(NO3)2, KOH, H2SO4.
Lời giải:
Dãy dung dịch làm đổi màu quỳ tím thành xanh là dãy gồm các dung dịch bazơ: NaOH, Ba(OH)2, Ca(OH)2, KOH
Đáp án cần chọn là: C
Bài 4: Tên gọi của Al(OH)3 là:
A. Nhôm (III) hidroxit.
B. Nhôm hidroxit.
C. Nhôm (III) oxit.
D. Nhôm oxit.
Lời giải:
Al(OH)3: nhôm hidroxit
Đáp án cần chọn là: B
Chú ý: Không gọi là Nhôm (III) hidroxit vì nhôm chỉ có 1 hóa trị III. Cách gọi này chỉ ứng với kim loại có nhiều hóa trị
Bài 5: Cho 0,1 mol NaOH tác dụng với 0,2 mol HCl, sản phẩm sinh ra sau phản ứng là muối NaCl và nước. Khối lượng muối NaCl thu được là
A. 11,7 gam.
B. 5,85 gam.
C. 4,68 gam.
Lời giải:
PTHH: NaOH + HCl → NaCl + H2O
Xét tỉ lệ: 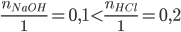 => HCl dư, NaOH phản ứng hết
=> HCl dư, NaOH phản ứng hết
=> tính số mol NaCl theo NaOH
PTHH: NaOH + HCl → NaCl + H2O
Tỉ lệ PT: 1mol 1mol 1mol
P/ứng: 0,1mol → 0,1mol
=> Khối lượng muối NaCl thu được là: mNaCl = 0,1.58,5 = 5,85 gam
Đáp án cần chọn là: B
Bài 6: Khối lượng muối thu được khi cho 9,75 gam kẽm tác dụng với 9,8 gam axit sunfuric (H2SO4) là
A. 24,15 gam
B. 19,32 gam
C. 16,1 gam
D. 17,71 gam
Lời giải:
Số mol kẽm là: nZn= ![]() =0,15mol
=0,15mol
Số mol H2SO4 là: nH2SO4= ![]() =0,1mol
=0,1mol
PTHH: Zn + H2SO4 → ZnSO4 + H2
Xét tỉ lệ: 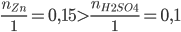 => Zn dư, H2SO4 phản ứng hết
=> Zn dư, H2SO4 phản ứng hết
=> tính số mol muối ZnSO4 theo số mol H2SO4
PTHH: Zn + H2SO4 → ZnSO4 + H2
Tỉ lệ PT: 1mol 1mol 1mol
P/ứng: 0,1mol → 0,1mol
=> Khối lượng ZnSO4 là: mZnSO4=0,1.161=16,1gam
Đáp án cần chọn là: C

