Lý thuyết Hóa học 8 Bài 31: Tính chất - Ứng dụng của hiđro hay, chi tiết
Lý thuyết Hóa học 8 Bài 31: Tính chất - Ứng dụng của hiđro hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 8 Bài 31: Tính chất - Ứng dụng của hiđro hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 8.

- Kí hiệu: H. Nguyên tử khối: 1
- Công thức hóa học của đơn chất: H2. Phân tử khối: 2
1. Tính chất vật lý:
Là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước
2. Tính chất hóa học
a. Tác dụng với oxi
Nếu đốt cháy hidro trong oxi: hidro cháy mạnh, trên thành lọ xuất hiện những giọt nước nhỏ
PTHH: 2H2 + O2 −to→ 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidro và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với đồng oxit CuO
Khi đốt nóng tới khoảng 400°C : bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
PTHH: H2 + CuO −to→ Cu +H2O
⇒ Hidro đã chiến oxi trong CuO. Vậy hidro có tính khử
⇒ở nhiệt độ thích hợp, hidro có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. do vậy hidro có tính khử. Các phản ứng này đều tỏa nhiệt
3. Ứng dụng
Do tính chất nhẹ, tính khử và khih cháy tỏa nhiềt nhiệt mà hidro ứng dụng trong đời sống
- làm nguyên liệu cho động cơ tên lửa, nhiên liệu cho động cơ ô tô thay cho xăng
- làm nguyên liệu điều chế axit
- dùng để điều chế kim loại từ oxit của chúng
- bơm vào khinh khí cầu, bóng thám
Bài tập tự luyện
Bài 1: Trong những oxit sau: CuO, MgO, Al2O3, Ag2O, Na2O, PbO. Có bao nhiêu oxit phản ứng với hiđro ở nhiệt độ cao?
A. 4
B. 5
C. 3
D. 1
Lời giải:
- H2 không tác dụng với các oxit: Na2O, K2O, BaO, CaO, MgO, Al2O3
=> Những oxit phản ứng với hiđro ở nhiệt độ cao là: CuO, Ag2O, PbO
Đáp án cần chọn là: C
Bài 2: Tính thể tích hiđro (đktc) để điều chế 5,6 (g) Fe từ FeO?
A. 2,24 lít.
B. 1,12 lít.
C. 3,36 lít.
D. 4,48 lít.
Lời giải:
nFe= ![]() = 0,1(mol)
= 0,1(mol)
PTHH: FeO + H2![]() Fe + H2O
Fe + H2O
Tỉ lệ PT: 1mol 1mol
Phản ứng: 0,1mol ← 0,1mol
⇒VH2=0,1.22,4=2,24(l)
Đáp án cần chọn là: A
Bài 3: Đốt cháy 2,8 lít H2 (đktc) sinh ra H2O
A. 1,4 lít.
B. 2,8 lít.
C. 5,6 lít.
D. 2,24 lít.
Lời giải:
Số mol khí hiđro là:nH2 = 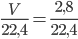 = 0,125mol
= 0,125mol
PTHH: 2H2 + O2![]() 2H2O
2H2O
Tỉ lệ PT: 2mol 1mol 2mol
P/ứng: 0,125mol → 0,0625mol→ 0,125mol
=> Thể tích khí oxi là: VO2=22,4.n=22,4.0,0625=1,4 lít
Đáp án cần chọn là: A
Bài 4: Cho 8 gam CuO tác dụng với 1,12 lít khí H2 ở nhiệt độ cao. Sau phản ứng thấy có m gam chất rắn. Giá trị của m là
A. 0,64
B. 6,4
C. 0,72
D. 7,2
Lời giải:
Số mol CuO là: nCuO = ![]() = 0,1mol
= 0,1mol
Số mol khí H2 là:nH2 = ![]() = 0,05mol
= 0,05mol
PTHH: CuO + H2![]() Cu + H2O
Cu + H2O
Vì đầu bài cho số mol 2 chất phản ứng => Xét tỉ lệ dư thừa
Ta có: 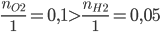 => CuO còn dư, H2 phản ứng hết
=> CuO còn dư, H2 phản ứng hết
=> tính toán theo H2
Vì CuO còn dư nên chất rắn thu được sau phản ứng gồm Cu sinh ra và CuO dư
PTHH: CuO + H2![]() Cu + H2O
Cu + H2O
Tỉ lệ PT: 1mol 1mol 1 mol
P/ứng: 0,05mol ← 0,05mol → 0,05mol
=> Khối lượng Cu sinh ra là: mCu = 0,05.64 = 3,2 gam
Khối lượng CuO phản ứng là: mCuO phản ứng = 0,05.80 = 4 gam
=> Khối lượng CuO dư là: mCuO dư = mCuO ban đầu – mCuO phản ứng = 8 – 4 = 4 gam
=> Khối lượng chất rắn thu được sau phản ứng là
mchất rắn = mCu sinh ra + mCuO dư = 3,2 + 4 = 7,2 gam
Đáp án cần chọn là: D
Bài 5: Khử hoàn toàn 8 gam một oxit của kim loại R (có hoá trị II) cần vừa đủ 2,24 lít H2 (đktc). Kim loại R là:
A. Cu.
B. Mg.
C. Zn.
D. Fe.
Lời giải:
Gọi công thức của oxit là RO
PTHH: RO + H2![]() R + H2O
R + H2O
nH2= ![]() = 0,1(mol)
= 0,1(mol)
Theo PTHH: nRO = nH2 = 0,1 (mol)
=> (R + 16).0,1 = 8
=> R + 16 = 80
=> R = 64 (Cu)
Đáp án cần chọn là: A

