Lý thuyết Hóa học 8 Bài 36: Nước hay, chi tiết
Lý thuyết Hóa học 8 Bài 36: Nước hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt Lý thuyết Hóa học 8 Bài 36: Nước hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 8.

1. Thành phần hóa học
a. Sự phân hủy nước
- Khi cho dòng điện một chiều đi qua nước, trên bề mặt hai điện cực sinh ra khí hidro và oxi với tỉ lệ thể tích 2:1
PTHH: 2H2O −điện phân→ 2H2 + O2
b. Sự tổng hợp nước
Đốt bằng tia lửa điện hỗn hợp 2 thể tích hidro và 2 thể tích oxi, ta thấy sua cùng hỗn hợp chỉ còn 1 thể tích oxi. Vậy 1 thể tích oxi đã hóa hợp với 2 thể tích hidro tạo thành nước
PTHH: 2H2 + O2 −to→ 2H2O
c. Kết luận
Nước là hợp chất tạo bởi 2 nguyên tố oxi và hidro. Chúng đã hóa hợp với nhau
Bằng thực nghiệm, người ta tìm được CTHH của nước là H2O
2. Tính chất
a. Tính chất vật lý
Là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị
Sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C
Khối lượng riêng ở 4°C là 1 g/ml (hay 1kg/lít)
Có thể hòa tan được nhiều chất rắn ( muối ăn, đường,…), chất lỏng ( còn, axit), chất khí (HCl,…)
b. Tính chất hóa học
Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: 2K + 2H2O → 2KOH + H2
Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
3. Vai trò của nước và cách chống ô nhiễm nguồn nước:
- Vai trò
+ Hòa tan chất dinh dưỡng cho cơ thể sống
+ Tham gia vào quá trình hóa học trong cơ thể người và động vật
+ Có vai trò rất quan trọng trong đời sống: sản xuất công nghiệp, nông nghiệp, giao thông vân tải,…
- Cách chống ô nhiễm
+ Không vứt rác thải xuống nguồn nước
+ Xử lý nước thải trước khi cho nước thải chảy vào sông, hồ, biển.
Bài tập tự luyện
Bài 1: Hòa tan 21,3 gam P2O5 vào nước dư, thu được m gam H3PO4. Tính m
A. 14,7.
B. 29,4.
C. 44,1.
D. 19,6.
Lời giải:
Số mol P2O5 là: nP2O5 = ![]() = 0,15mol
= 0,15mol
PTHH: P2O5 + 3H2O → 2H3PO4
Tỉ lệ PT: 1mol 2mol
P/ứng: 0,15mol → 0,3mol
=> Khối lượng H3PO4 là: mH3PO4=0,3.98=29,4gam
Đáp án cần chọn là: B
Bài 2: Hòa tan V lít khí SO3 (đktc) gam vào nước dư, thu được 49 gam H2SO4.
Tính V
A. 11,2.
B. 22,4.
C. 16,8.
D. 19,6.
Lời giải:
Số mol H2SO4 là: nH2SO4= 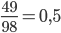 mol
mol
PTHH: SO3 + H2O → H2SO4
Tỉ lệ PT: 1mol 1mol
P/ứng: 0,5mol ← 0,5mol
=> Thể tích khí SO3 phản ứng là: VSO3 =0,5.22,4=11,2 lít
Đáp án cần chọn là: A
Bài 3: Hòa tan hỗn hợp gồm (28,4 gam P2O5 và 12 gam SO3) vào nước dư, thu được m gam hỗn hợp gồm (H3PO4 và H2SO4). Tính m
A. 39,2 gam.
B. 34,3 gam.
C. 35,9 gam.
D. 53,9 gam.
Lời giải:
Số mol P2O5 là: nP2O5= ![]() = 0,2mol
= 0,2mol
Số mol SO3 là: nSO3= ![]() = 0,15mol
= 0,15mol
PTHH: P2O5 + 3H2O → 2H3PO4
Tỉ lệ PT: 1mol 2mol
P/ứng: 0,2mol → 0,4mol
=> Khối lượng H3PO4 là:mH3PO4=0,4.98=39,2gam
PTHH: SO3 + H2O → H2SO4
Tỉ lệ PT: 1mol 1mol
P/ứng: 0,15mol → 0,15mol
=> Khối lượng H2SO4 là: mH2SO4=0,15.98=14,7gam
=> Tổng khối lượng H3PO4 và H2SO4 thu được là: m = 39,2 + 14,7 = 53,9 gam
Đáp án cần chọn là: D
Bài 4: Hòa tan 11,28 gam K2O vào nước dư, thu được m gam KOH. Tính m
A. 6,72 gam.
B. 13,44 gam.
C. 8,4 gam.
D. 8,96 gam
Lời giải:
Số mol K2O phản ứng là:nK2O= ![]() =0,12mol
=0,12mol
PTHH: K2O + H2O → 2KOH
Tỉ lệ PT: 1mol 2mol
P/ứng: 0,12mol → 0,24mol
=> Khối lượng KOH thu được là: mKOH = 0,24.56 = 13,44 gam
Đáp án cần chọn là: B
Bài 5: Hòa tan hỗn hợp gồm (12,4 gam Na2O và 15,3 gam BaO) vào nước dư, thu được m gam hỗn hợp gồm NaOH và Ba(OH)2. Tính m
A. 33,1 gam.
B. 17,1 gam.
C. 49,65 gam.
D. 26,48 gam.
Lời giải:
Số mol Na2O là: nNa2O= ![]() =0,2 mol
=0,2 mol
Số mol BaO là: nBaO= ![]() =0,1 mol
=0,1 mol
PTHH: Na2O + H2O → 2NaOH
Tỉ lệ PT: 1mol 2mol
P/ứng: 0,2mol → 0,4mol
=> Khối lượng NaOH thu được là: mNaOH = 0,4.40 = 16 gam
PTHH: BaO + H2O → Ba(OH)2
Tỉ lệ PT: 1mol 1mol
P/ứng: 0,1mol → 0,1mol
=> Khối lượng Ba :mBa(OH)2=0,1.171=17,1gam
=> Tổng khối lượng NaOH và Ba(OH)2 là:
m = 16 + 17,1 = 33,1 gam
Đáp án cần chọn là: A

